PHARMAKOLOGIE
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Perosphere und Daiichi Sankyo planen gemeinsam klinische Studie zur Wirksamkeit und Sicherheit des Edoxaban-Antidots PER977
Mount Kisco, New York/USA, und Tokio/Japan (6. Mai 2013) – Die Pharmaunternehmen Perosphere und Daiichi Sankyo haben eine Vereinbarung bezüglich der Durchführung klinischer Studien getroffen. In diesem Rahmen wird Daiichi Sankyo eine Phase-I-Studie zu Sicherheit, Verträglichkeit und Wirksamkeit von PER977 fördern und unterstützen. Der neue Wirkstoff hebt die gerinnungshemmende Wirkung von Edoxaban, einem von
WEITERLESEN »
Rote-Hand-Brief zu Tavor® (Lorazepam) Injektionslösung: Chargenrückruf wegen möglicher Verunreinigung mit Glassplittern
Berlin (2. Mai 2013) – Tavor® (Lorazepam) pro injectione 2 mg Injektionslösung ist zugelassen zur Beruhigung (Basissedierung) vor und während operativer und diagnostischer Eingriffe Behandlungseinleitung schwerer neurotischer Angstsymptomatik und ausgeprägter Phobien adjuvanten kurzfristigen Behandlung schwerer Angst- und Erregungszustände bei Psychosen und Depressionen Behandlung des Status epilepticus aufgrund verschiedenartiger fokaler oder generalisierter Anfallstypen.
Rote-Hand-Brief zu Pletal® (Cilostazol): Neue Informationen in Bezug auf die Sicherheit
Berlin (2. Mai 2013) – Pletal® (Cilostazol) ist zugelassen zur Verlängerung der maximalen und schmerzfreien Gehstrecke bei Patienten mit Claudicatio intermittens, die keinen Ruheschmerz und keine Anzeichen von peripheren Gewebsnekrosen haben (periphere arterielle Verschlusskrankheit Fontaine Stadium II).
BMG: Neues Register beim Bundesinstitut für Arzneimittel und Medizinprodukte über Lieferengpässe bei Arzneimitteln
Berlin (25. April 2013) – In Deutschland werden jedes Jahr über 1,6 Milliarden Arzneimittelpackungen abgegeben. Das sind im Durchschnitt 4,5 Millionen Packungen pro Tag. Trotz der sehr guten Versorgung mit Arzneimitteln in Deutschland kam es in den letzten Monaten zu Lieferengpässen bei einzelnen Arzneimitteln. Besonders betroffen waren hiervon die Krankenhäuser.
BfArM: Arzneimittel unter zusätzlicher Überwachung
Bonn (25. April 2013) – Die Europäische Union (EU) hat ein neues Verfahren zur Kennzeichnung von Arzneimitteln eingeführt, die besonders engmaschig von den Regulierungsbehörden überwacht werden. Diese Arzneimittel werden als Arzneimittel unter „zusätzlicher Überwachung“ bezeichnet.
Transparenz bei unerwünschten Arzneimittelwirkungen: BfArM-Datenbank mit Verdachtsmeldungen jetzt öffentlich zugänglich
Bonn (23. April 2013) – Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) bietet seit heute einen Online-Zugang zu seiner Datenbank mit Verdachtsmeldungen unerwünschter Arzneimittelwirkungen an. Mit dem neuen Internetangebot steht Ärzten und Patienten jetzt eine weitere Möglichkeit offen, sich vertieft über Arzneimittelrisiken zu informieren.
BfArM: Nebenwirkungsmeldung durch Verbraucher (online)
Bonn (22. April 2013) – In der Europäischen Union wurden Änderungen im Bereich der Arzneimittelsicherheit (Pharmakovigilanz) implementiert, um Meldungen von Verdachtsfällen von Nebenwirkungen durch Patienten und Verbraucher (z.B. Erziehungsberechtigte, Angehörige) eine größere Bedeutung zukommen zu lassen. Danach sollen in der Europäischen Union Patienten und Verbraucher die Möglichkeit bekommen, den Verdacht einer Nebenwirkung direkt, möglichst
WEITERLESEN »
AkdÄ: Meldungen von schweren hämolytischen Reaktionen nach intravenöser Gabe von Immunglobulinen
Berlin (21. März 2013) – Intravenöse Immunglobuline (IVIG) sind zugelassen zur Substitutionsbehandlung bei verschiedenen angeborenen oder erworbenen Störungen der Antikörperbildung (z.B. bei chronisch lymphatischer Leukämie, Multiplem Myelom oder nach allogener hämatopoetischer Stammzellentransplantation) sowie zur Immunmodulation bei einigen Autoimmunerkrankungen (z.B. Immunthrombozytopenie, Guillain-Barré-Syndrom) und Erkrankungen unbekannter Ätiologie (z.B. Kawasaki-Syndrom) (1). Die Querschnitts-Leitlinien der Bundesärztekammer zur Therapie
WEITERLESEN »
ADHS bei Erwachsenen: G-BA regelt Einzelheiten zur Verordnungsfähigkeit von Methylphenidat-haltigen Arzneimitteln
Berlin (21. März 2013) – Der Gemeinsame Bundesausschuss (G-BA) hat am Donnerstag in Berlin Einzelheiten zu der in Ausnahmefällen möglichen Verordnung von Methylphenidat-haltigen Medikamenten (Stimulantien) bei Erwachsenen mit ADHS (Aufmerksamkeitsdefizit-Hyperaktivitätsstörung) zulasten der gesetzlichen Krankenversicherung (GKV) beschlossen.
BfArM – Informationsbrief zu NeuroBloc® (Botulinumtoxin Typ B): Risiken bei der „Off-Label“ Anwendung
Bonn (25. Februar 2013) – Im Zusammenhang mit NeuroBloc® beim Einsatz außerhalb der zugelassenen Indikation („Off-Label“) wurden schwere unerwünschte Ereignisse beobachtet.
Rote-Hand-Brief zu tolperisonhaltigen Produkten: Risiko von Überempfindlichkeitsreaktionen
Bonn (21. Februar 2013) – Die pharmazeutischen Unternehmer informieren über die Einschränkung der Indikation für tolperisonhaltige Produkte und das Risiko von Überempfindlichkeitsreaktionen.
„PREFER in VTE“ nimmt ersten Patienten auf: Europäisches Patientenregister zu venösen Thromboembolien (VTE) gestartet: „PREFER in VTE“ nimmt ersten Patienten auf
Anhand dieses neuen Registers werden die Daten von 4.000 Patienten mit VTE aus sieben europäischen Ländern gesammelt, um neue Erkenntnisse zur Patientenversorgung zu gewinnen. VTE zählen weltweit zu den führenden Krankheits- und Todesursachen [1]. München (20. Februar 2013) – Nach Angaben des Unternehmens Daiichi Sankyo Deutschland wurde der erste Patient in das Patientenregister „PREFER
WEITERLESEN »
Rote-Hand-Brief zu Prolia® (Denosumab): Risiko atypischer Femurfrakturen
Berlin (20. Februar 2013) – Denosumab ist als Prolia® zugelassen zur Behandlung der Osteoporose bei postmenopausalen Frauen mit erhöhtem Frakturrisiko und zur Behandlung von Knochenschwund im Zusammenhang mit Hormonablation bei Männern mit Prostatakarzinom mit erhöhtem Frakturrisiko; als Xgeva® ist es zugelassen zur Prävention von skelettbezogenen Komplikationen bei Erwachsenen mit Knochenmetastasen aufgrund solider Tumoren.
EMA überprüft aufgrund von Berichten über schwere Hautreaktionen das Nutzen-Risiko-Profil von Tetrazepam-haltigen Präparaten
Berlin (11. Februar 2013) – Das Benzodiazepin Tetrazepam (z.B. Musaril® sowie zahlreiche Generika) ist zugelassen zur Behandlung von schmerzreflektorischen Muskelverspannungen, z.B. als Folge von Erkrankungen der Wirbelsäule und der achsennahen Gelenke sowie bei spastischen Syndromen mit krankhaft gesteigerter Muskelspannung. Die Nationale VersorgungsLeitlinie (NVL) Kreuzschmerz weist auf die Nebenwirkungen der Substanz hin (z.B. Benommenheit, allergische
WEITERLESEN »
Rote-Hand-Brief zum kardiovaskulären Risiko bei Patienten mit essenzieller Thrombozythämie unter Xagrid® (Anagrelid)
Berlin (5. Februr 2013) – Anagrelid ist zur Verringerung der erhöhten Thrombozytenzahl bei Risikopatienten mit essenzieller Thrombozythämie vorgesehen, die ihre derzeitige Therapie nicht vertragen oder deren erhöhte Thrombozytenzahl durch ihre derzeitige Therapie nicht auf ein akzeptables Maß gesenkt werden kann (Zweitlinientherapie). Ein Risikopatient mit essenzieller Thrombozythämie weist eines oder mehrere der folgenden Merkmale auf:
WEITERLESEN »
Nanomedizin: Medikamente zielgerichtet freisetzen
Bern, Schweiz (24. Januar 2013) – Wissenschaftlern des Nationalen Forschungsprogramms "Intelligente Materialien" (NFP 62) ist es gelungen, Medikamente mittels eines magnetischen Nanoträgers kontrolliert freizusetzen. Dies eröffnet neue Möglichkeiten in der Entwicklung gezielter und effizienter Behandlungsmethoden, die weniger Nebenwirkungen nach sich ziehen. Manche Medikamente sind von Natur aus toxisch. Das gilt zum Beispiel für Krebsmedikamente:
WEITERLESEN »
EMA: PRAC empfiehlt Rücknahme der Zulassung von Tredaptive®
Berlin (14. Januar 2013) – Der Ausschuss für Risikobewertung in der Pharmakovigilanz bei der EMA (PRAC) hat die Rücknahme der Zulassung von Tredaptive® (Retardierte Nikotinsäure plus Laropiprant) empfohlen. Aufgrund neuer Daten aus der HPS2-THRIVE Studie (Heart Protection Study 2-Treatment of HDL to Reduce the Incidence of Vascular Events) wurde das Nutzen-Risiko-Profil als ungünstig eingestuft.
WEITERLESEN »
Prevenar13® als erster und einziger Pneumokokken-Konjugatimpfstoff nun auch für Kinder und Jugendliche zwischen 6 und 17 Jahren zugelassen
Berlin (9. Januar 2013) – Der 13-valente, adsorbierte Pneumokokken-Konjugatimpfstoff Prevenar13® ist in der Europäischen Union nun auch für die Anwendung bei Kindern und Jugendlichen im Alter von 6 bis 17 Jahren zugelassen. Der Impfstoff wird bei Kindern und Jugendlichen für die aktive Immunisierung zur Prävention von invasiven Erkrankungen, Pneumonie und akuter Otitis media, die
WEITERLESEN »
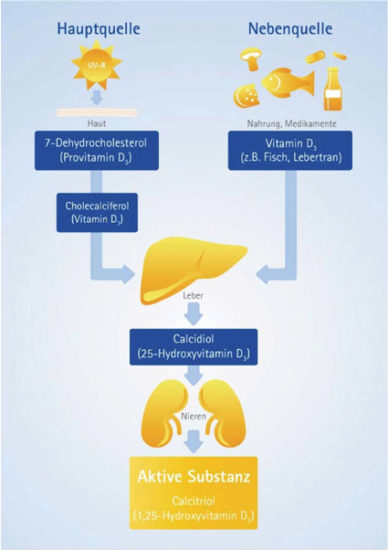
Vitamin D-Mangel: Risikofaktor für Mortalität?
Hamburg (9. Januar 2013) – „Etwa die Hälfte der deutschen Bevölkerung weist nur unzureichende Vitamin D-Werte auf“ (1,2,3,4), sagte PD Dr. Stefan Pilz von der Medizinischen Universität Graz auf der Presseveranstaltung Aktuelle Empfehlungen zu Vitamin D in Hamburg. Bedenklich, denn oft geht Vitamin D-Mangel nicht nur mit ständigen Erkältungen und einem Risiko für geschwächte
WEITERLESEN »
wichtige Mitteilung bezüglich der zugelassenen Dosierung für die perkutane Koronarintervention (PCI)
Berlin (9. Januar 2013) – Bivalirudin ist als Antikoagulans für erwachsene Patienten bestimmt, die sich einer perkutanen Koronarintervention (PCI) unterziehen (einschließlich primärer PCI bei ST-Hebungsinfarkt (STEMI)). Es ist auch zugelassen zur Behandlung von Patienten mit instabiler Angina pectoris/Nicht-ST-Hebungsinfarkt (iAP/NSTEMI) bei einem Notfalleingriff oder wenn eine frühzeitige Intervention vorgesehen ist. Bivalirudin sollte mit Acetylsalicylsäure und
WEITERLESEN »
Rote-Hand-Brief zu Pradaxa® (Dabigatranetexilat): Kontraindiziert bei Patienten mit künstlichen Herzklappen!
Berlin (9. Januar 2013) – Der direkte Thrombinhemmer Dabigatranetexilat ist zugelassen zur Primärprävention von venösen thromboembolischen Ereignissen bei erwachsenen Patienten nach elektivem chirurgischen Hüft- oder Kniegelenksersatz und zur Prävention von Schlaganfall und systemischer Embolie bei erwachsenen Patienten mit nicht valvulärem Vorhofflimmern und einem oder mehreren Risikofaktoren.
Rote-Hand-Brief zu Tredaptive® (Nikotinsäure/Laropiprant): Keine neuen Patienten auf Tredaptive® einstellen!
Berlin (2. Januar 2013) – Das Kombinationspräparat Tredaptive® (1000 mg Nikotinsäure/20 mg Laropiprant) ist zugelassen zur Behandlung von Fettstoffwechselstörungen, insbesondere bei erwachsenen Patienten mit kombinierter Dyslipidämie, und bei erwachsenen Patienten mit primärer Hypercholesterinämie. Es sollte in Kombination mit Statinen bei Patienten angewendet werden, bei denen die cholesterinsenkende Wirkung einer Statin-Monotherapie unzureichend ist. Es kann als
WEITERLESEN »
Rote-Hand-Brief zur Gefahr lebensbedrohlicher Luft- oder Gasembolien bei der Verwendung eines Spray-Applikators zur Verabreichung von Evicel®-Lösungen
Berlin (10. Dezember 2012) – Evicel® (Humanfibrinkleber) wird als unterstützende Behandlung zur Verbesserung der Hämostase bei Operationen angewendet, bei denen chirurgische Techniken nicht ausreichend sind.
Bayer erhält Zulassung für EYLEA® zur Behandlung der feuchten altersbedingten Makula-Degeneration in Europa
Leverkusen (27. November 2012) – Bayer HealthCare hat von der Europäischen Kommission die Zulassung für EYLEA®, auch bekannt als Aflibercept (VEGF Trap-Eye), für die Behandlung von Erwachsenen mit neovaskulärer (feuchter) altersbedingter Makula-Degeneration (AMD) in der empfohlenen Dosierung von zwei Milligramm (mg) erhalten. Die Behandlung mit EYLEA® beginnt zunächst mit drei Injektionen in monatlichem Abstand,
WEITERLESEN »
Als einziges der neuen oralen Antikoagulanzien: Rivaroxaban (Xarelto®) jetzt auch zur Akutbehandlung und Sekundärprophylaxe der Lungenembolie zugelassen
Rivaroxaban ist ebenso wirksam wie die Standardtherapie, halbiert aber die Rate an schweren Blutungen Rivaroxaban weist das breiteste Einsatzgebiet aller modernen oralen Antikoagulanzien auf Köln (23. November 2012)* – Die Zulassungserweiterung von Rivaroxaban ist ein therapeutischer Fortschritt, auf den Ärzte und Patienten mit Lungenembolien lange warten mussten. "Der direkte Faktor-Xa-Inhibitor ist seit mehr
WEITERLESEN »
HOKUSAI-VTE – Daiichi Sankyo schließt die Patientenrekrutierung für die größte Phase-III-Studie zur VTE-Behandlung und Rezidivprophylaxe mit Edoxaban einmal täglich ab
München (8. November 2012) – Die Patientenrekrutierung von HOKUSAI-VTE, der größten Phase-III–Studie zur Behandlung und Prävention rezidivierender venöser Thromboembolien (VTE) mit Edoxaban einmal täglich, ist abgeschlossen: Weit mehr als 8.250 Patienten aus über 400 Prüfzentren in 38 Ländern wurden rekrutiert.1,2 HOKUSAI-VTE prüft den Nutzen der Antikoagulation mit dem oralen direkten Faktor-Xa-Hemmer Edoxaban (60 mg
WEITERLESEN »
Relaunch der Marke Retterspitz aus Anlass des 110-jährigen Jubiläums
Schwaig bei Nürnberg (8. Oktober 2012) – Die Marke Retterspitz, die zweitälteste Apothekenmarke Deutschlands, feiert 110-jähriges Bestehen und präsentiert aus diesem Anlass die bekannten Retterspitz Produkte unter dem Leitsatz „Neue Optik – bewährte Rezepturen“ im neuen Design und setzt auf ein hochwertiges, modernes Erscheinungsbild. Das gesamte Erscheinungsbild des Unternehmens und das Produkt-Portfolio
WEITERLESEN »
Informationsbrief zu Agomelatin (Valdoxan®/Thymanax®): Risiko von Hepatotoxizität
Berlin (15. Oktober 2012) – Agomelatin ist ein Antidepressivum zur Behandlung von Episoden einer Major Depression bei Erwachsenen. Der Hersteller informiert in einer Mitteilung über das Risiko einer Hepatotoxizität von Agomelatin. Seit Markteinführung im Jahr 2009 wurden schwerwiegende Fälle von Leberschäden berichtet, einschließlich sechs Fällen von Leberinsuffizienz.
Neueinführung, die größere Dosisflexibilität erlaubt: Dysport® jetzt auch mit 300 Einheiten pro Ampulle
Ettlingen (8. Oktober 2012) – Die Ipsen Pharma GmbH, die deutsche Niederlassung von Ipsen (Euronext: IPN; ADR: IPSEY) berichtet, dass Dysport® (Botulinumtoxin A) ab sofort neben der etablierten Dosierung mit 500 Einheiten pro Ampulle auch mit 300 Einheiten pro Ampulle erhältlich ist. Mit der Neueinführung erweitert sich das bestehende Dysport®-Portfolio und bietet Anwendern damit
WEITERLESEN »
Neu: Rotigotin als Raumtemperatur-Pflaster – Je einfacher desto besser für Parkinson- und RLS-Patienten
Hamburg (27. September 2012) – Durch eine Rezepturänderung kann Rotigotin transdermales System (Neupro®) jetzt auch ohne Kühlung bei Raumtemperatur bis 25°C gelagert werden. Für den Alltag der Patienten mit idiopathischem Parkinson oder mittelschwerem bis schwerem Restless-Legs-Syndrom (RLS) bedeutet dies mehr Unabhängigkeit und Flexibilität: Sie können die Pflaster gemeinsam mit anderen Medikamenten aufbewahren und beim
WEITERLESEN »
Rote-Hand-Brief zu Zostex® (Virustatikum Brivudin): potenziell tödliche Wechselwirkungen zwischen Zostex® (Brivudin) und 5-Fluoropyrimidinen
Berlin (4. September 2012) – Das Virusstatikum Zostex® ist zugelassen zur Behandlung des akuten Herpes zoster bei immunkompetenten Erwachsenen. 5-Fluoropyrimidine sind antineoplastisch (z.B. 5-Fluorouracil, 5-FU) und antimykotisch (z.B. Flucytosin) wirksame Arzneimittel.
Rote-Hand-Brief zu Xgeva® (Denosumab): schwere symptomatische Hypokalzämie mit Todesfolge
Berlin (4. September 2012) – Xgeva® ist zugelassen zur Prävention von skelettbezogenen Komplikationen (pathologische Fraktur, Bestrahlung des Knochens, Rückenmarkkompression oder operative Eingriffe am Knochen) bei Erwachsenen mit Knochenmetastasen aufgrund solider Tumoren.
Rote-Hand-Brief zu Tavanic® (Levofloxacin) Filmtabletten und Infusionslösung: Einschränkung der Indikation und neue schwerwiegende Nebenwirkungen
Berlin (3. September 2012) – Tavanic® ist ein Antibiotikum aus der Gruppe der Fluorchinolone. Die antibakterielle Wirkung wird über eine Hemmung des Enzyms Gyrase in den Bakterienzellen erzielt. Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittel-Agentur (EMA) kam nach Abschluss eines Verfahrens zur Harmonisierung der nationalen Produktinformationen zu dem Ergebnis, dass bestimmte Anwendungsgebiete von
WEITERLESEN »
AXA Private Equity übernimmt die Riemser Arzneimittel AG
Greifswald-Insel Riems (21. August 2012) – Das international tätige Specialty-Pharma-Unternehmen mit Sitz in Greifswald konzentriert sich auf den Vertrieb und das Life-Cycle-Management von Arzneimitteln in therapeutischen Nischen mit einem hohen medizinischen Bedarf in den Bereichen Onkologie, Infektiologie und Dermatologie. Riemser setzte 2011 mit rund 500 Mitarbeitern circa 100 Millionen Euro um und wächst profitabel. AXA
WEITERLESEN »
Rote-Hand-Brief zum Zusammenhang von Calcitonin und Malignität: Einschränkung der Indikation und Marktrücknahme des Nasensprays
Berlin (15. August 2012) – Calcitonin war bislang als Nasenspray zugelassen zur Risikoreduktion von vertebralen Frakturen bei postmenopausaler Osteoporose sowie als Injektionslösung zur Behandlung des Morbus Paget, zur Prävention eines akuten Verlustes an Knochenmasse nach einer plötzlichen Immobilisation und zur Behandlung einer Hyperkalzämie bei malignen Erkrankungen.
Informationsbrief zu Zofran® (Ondansetron): Neue Dosierungsempfehlungen aufgrund dosisabhängiger Verlängerung des QTc-Intervalls
Berlin (14. August 2012) – Der 5-HT3-Antagonist (Serotoninantagonist) Ondansetron ist zugelassen zur Behandlung von Übelkeit, Brechreiz und Erbrechen bei einer Therapie mit Zytostatika oder einer Strahlentherapie sowie zur Prophylaxe von Übelkeit, Brechreiz und Erbrechen nach Operationen. Ondansetron verlängert dosisabhängig das QTc-Intervall. Dies kann zu Torsade de Pointes führen, einer potenziell lebensbedrohlichen Herzrhythmusstörung. Die Empfehlungen
WEITERLESEN »
Rote-Hand-Brief Doribax® (Doripenem): Neue Empfehlungen hinsichtlich Dosierung, Behandlungsdauer und Vorsichtsmaßnahmen bei Behandlung einer nosokomialen Pneumonie
Berlin (11. Juli 2012) – Das Antibiotikum Doripenem aus der Gruppe der Carbapeneme weist ein breites antimikrobielles Wirkspektrum auf und ist zugelassen zur Behandlung folgender Infektionen bei Erwachsenen: nosokomiale Pneumonie (einschließlich Beatmungspneumonie), komplizierte intraabdominelle Infektionen und komplizierte Harnwegsinfektionen.
Weihrauch als Heilmittel
Jena (9. Juli 2012) – Er gehörte schon zu den Geschenken der drei Weisen aus dem Morgenland: Neben Myrrhe und Gold hatten sie für das neugeborene Jesuskind auch Weihrauch im Gepäck. Seit der Antike gehört der aromatische Duft des verbrennenden Weihrauchharzes zu vielen religiösen Zeremonien und ist bis heute in der Kirche Ausdruck besonderer
WEITERLESEN »
Bayer HealthCare: Zwei weitere große nicht-interventionelle Xarelto Studien in der Schlaganfall-Prävention und der TVT-Therapie
Leverkusen (3. Juli 2012) – Bayer HealthCare gibt den Start zweier weiterer nicht interventioneller Studien zur Untersuchung des oralen Gerinnungshemmers Xarelto® (Rivaroxaban) unter klinischen Alltagsbedingungen bekannt. Mit XANTUS soll der Schutz, den Rivaroxaban den Patienten bietet, weiter beurteilt und das Sicherheitsprofil des Medikaments in der Schlaganfall-Prävention bei Patienten mit nicht-valvulärem Vorhofflimmern (VHF) bestätigt werden.
WEITERLESEN »
Rückruf des Adrenalin-Autoinjektors „Anapen“: Patienten sollen Notfallmedikament wegen möglicher fehlerhafter Abgabe des Wirkstoffes schnell austauschen
Bonn (4. Juni 2012) – Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) rät Patienten, die im Besitz des Adrenalin-Autoinjektors „Anapen“ sind, diesen dringend gegen ein anderes geignetes Arzneimittel auszutauschen. Betroffen sind die Arzneimittel Anapen® 300 μg Adrenalin in 0,3 ml Injektionslösung, Fertigspritze und Anapen® Junior 150 μg Adrenalin in 0,3 ml Injektionslösung, Fertigspritze.
Rote-Hand-Brief zu schweren Hypersensitivitätsreaktionen unter Adenuric® (Febuxostat)
Berlin (22. Mai 2012) – Febuxostat ist zugelassen zur Behandlung von Erwachsenen mit chronischer Hyperurikämie bei Erkrankungen, die bereits zu Uratablagerungen geführt haben.
Information des BfArM zu Carboplatin-haltigen Arzneimitteln: Bildung von unlöslichen Partikeln in Konzentraten zur Herstellung von Infusionslösungen
Berlin (18. Mai 2012) – Carboplatin wird allein oder in Kombination mit anderen antineoplastisch wirksamen Arzneimitteln unter anderem eingesetzt bei der Behandlung von epithelialen Ovarialkarzinomen, kleinzelligen Bronchialkarzinomen und Plattenepithelkarzinomen des Kopf-Hals-Bereichs sowie zur palliativen Therapie von Zervixkarzinomen.
Roche stellt klinische Entwicklung des Lipidsenkers Dalcetrapib ein
Basel, Schweiz (7. Mai 2012) – Roche hat heute bekannt gegeben, dass ein unabhängiges Gremium (Data Safety Monitoring Board) aufgrund der Ergebnisse der zweiten Interimsanalyse empfohlen hat, die Phase-III-Studie dal-OUTCOMES mit Dalcetrapib wegen mangelnder klinischer Wirksamkeit zu beenden. Die so genannte dal-OUTCOMES-Studie prüft die Wirksamkeit und Sicherheit von Dalcetrapib als Zusatz zur Standardtherapie bei
WEITERLESEN »
Thromboseprophylaxe und -therapie: Überzeugende Daten für Rivaroxaban
EINSTEIN PE-Studie: Rivaroxaban ist in der Akutbehandlung und Sekundärprävention von Lungenembolien als Einzelsubstanz ebenso wirksam wie die Kombination aus Enoxaparin und Warfarin und hat dabei ein um 50 Prozent niedrigeres Risiko für schwere Blutungen. ORTHO-TEP Register: Ergebnisse der RECORD-Studien auch im klinischen Alltag bestätigt. ROCKET AF-Subanalyse: In der Gruppe der Patienten mit Vorhofflimmern und
WEITERLESEN »
Belimumab bei Lupus: Zusatznutzen ist nicht belegt
Köln (2. Mai 2012) – Belimumab (Handelsname Benlysta ®) ist seit Februar 2012 als Zusatzbehandlung für erwachsene Patientinnen und Patienten mit der Autoimmunerkrankung "systemischer Lupus erythematodes" (SLE) zugelassen. Der monoklonale Antikörper kommt nur infrage, wenn die Erkrankung trotz Standardbehandlung weiter aktiv ist. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hat jetzt den Zusatznutzen
WEITERLESEN »
Pflaster gegen Heuschnupfen
Zürich, Schweiz (19. April 2012) – Ein Pflaster mit Pollenextrakten kann die Symptome des Heuschnupfens um 70 Prozent lindern. Dies zeigen Forschende am Universitätsspital Zürich in einem vom Schweizerischen Nationalfonds geförderten klinischen Versuch. Laufende Nase, tränende Augen: Menschen, die an Heuschnupfen leiden, freuen sich nicht auf den Spätfrühling, wenn die Gräser blühen. In der
WEITERLESEN »
Belatacept nach Nierentransplantation: Geringer Zusatznutzen für bestimmte Patienten
Köln (16. April 2012) – Belatacept (Handelsname Nulojix®) ist seit Juni 2011 zugelassen, um einer Abstoßungsreaktion des Körpers auf das Spenderorgan (Transplantat) bei Erwachsenen vorzubeugen, die eine Nierentransplantation erhalten haben. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hat den Zusatznutzen des Wirkstoffs gemäß AMNOG überprüft.
Informationsbrief zu ViaSpan® Organkonservierungslösung
Berlin (10. April 2012) – ViaSpan® ist indiziert für die Aufbewahrung von Leber, Niere oder Pankreas vor der Implantation in einen Organempfänger. Im Rahmen von Routine-Kontrollen wurde festgestellt, dass es beim Herstellungsverfahren möglicherweise zu einer Kontamination mit Bacillus cereus gekommen ist. Aktuell gibt es keinen Nachweis einer Kontamination der auf dem Markt befindlichen Chargen.
WEITERLESEN »
Rote-Hand-Brief zum Risiko einer versehentlichen Überdosierung von Perfalgan® Infusionslösung (Paracetamol i.v.)
Berlin (28. März 2012) – Paracetamol ist als intravenöse Infusionslösung (10 mg/ml) indiziert für die Kurzzeitbehandlung von mäßig starken Schmerzen, besonders nach Operationen, und für die Kurzzeitbehandlung von Fieber, wenn die intravenöse Anwendung aufgrund einer dringend erforderlichen Schmerz- oder Fieberbehandlung klinisch gerechtfertigt ist oder wenn andere Arten der Anwendung nicht möglich sind.
Rote-Hand-Brief zum Risiko von zu schnellen Serumnatriumanstiegen unter Samsca® (Tolvaptan)
Berlin (28. März 2012) – Der Vasopressin-Antagonist Tolvaptan ist zugelassen zur Behandlung von Erwachsenen mit Hyponatriämie als sekundäre Folge des Syndroms der inadäquaten Sekretion des antidiuretischen Hormons (SIADH).