MEDIZIN
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Chronische Hepatitis C Genotyp 1 und 4
Interferonfrei mit Simeprevir in 12 Wochen auch bei Zirrhose*
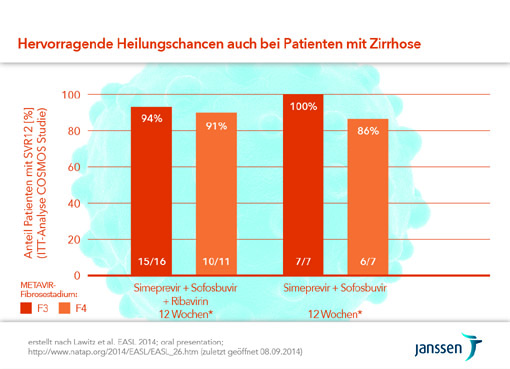
Neuss (20. November 2014) – Die dieses Jahr neu zugelassenen Therapieoptionen der chronischen Hepatitis C sind in der Versorgungsrealität angekommen – das zeigten die Diskussionen Anfang November 2014 beim diesjährigen Jahreskongress der amerikanischen Lebergesellschaft (American Association for the Study of Liver Diseases – AASLD) in Boston. Dank der Kombination verschiedener zumeist direkt antiviral wirksamer Arzneimittel hat mittlerweile die überwiegende Mehrheit der chronisch mit dem Hepatitis C-Virus (HCV) Infizierten eine sehr hohe Chance auf Heilung. Mit dem Proteaseinhibitor Simeprevir (Olysio®) ist in Kombination mit dem Polymeraseinhibitor Sofosbuvir bei einer definierten Patientengruppe mit HCV Genotyp 1 ein 12-wöchiges interferonfreies Therapieregime möglich.*[1] Auch Patienten mit Zirrhose können von der 12-wöchigen Therapie profitieren. Dies gilt ebenfalls für Patienten Nichtansprechen auf eine Vortherapie.** Die Heilungschancen lagen in der Phase-II Studie Cosmos bei über 90%.[2]
Bis heute sind bereits mehr als 900 Patienten in Deutschland mit chronischer Hepatitis Genotyp 1/4 mit einer Kombination aus Simeprevir und Sofosbuvir behandelt worden. In der Cosmos-Studie zeigte sich die Kombination hoch wirksam bei einem sehr guten Verträglichkeitsprofil.[2] 94% der eingeschlossenen Studien-teilnehmer – darunter auch Patienten mit Zirrhose und erfolgloser Vortherapie** – erzielten ein dauerhaftes Ansprechen 12 Wochen nach Behandlungsende (SVR12). Simeprevir und Sofosbuvir werden einmal täglich und für alle Patiententypen immer nur über 12 Wochen verabreicht. Basierend auf der klinischen Bewertung jedes einzelnen Patienten kann Ribavirin hinzugefügt werden. Unter allen derzeit zugelassenen Therapieregimen ist die Kombination aus Simeprevir und Sofosbuvir für Genotyp 1/4-Patienten mit Zirrhose das kürzeste und einzige interferonfreie Regime, für das Daten zur Anwendung bei Leberzirrhose vorliegen. Aktuell wird der Einsatz von Simeprevir und Sofosbuvir in Phase III Studien mit größerer Patientenzahl untersucht; die Publikation der Ergebnisse wird zum EASL Kongress 2015 im April angestrebt.
„Viele Patienten mit chronischer Hepatitis C haben einen dringenden Therapiebedarf und wir freuen uns, ihnen mit Olysio® eine sehr gut verträgliche und hoch wirksame Behandlungsmöglichkeit zu bieten“, erklärt Dr. Michael von Poncet, Medizinischer Direktor und Mitglied der Geschäftsführung von Janssen Deutschland. Durch den jüngsten Zusammenschluss mit Alios Biopharma befinden sich außerdem zwei weitere HCV-Medikamente in der Pipeline. Darüber hinaus engagiert sich Janssen, die Behandlungsrealität der Hepatitis C in Deutschland abzubilden und auszuwerten. Dazu unterstützt das Unternehmen das Hepatitis C-Register, eine Initiative der deutschen Leberstiftung in Kooperation mit dem Berufsverband der Niedergelassenen Gastroenterologen (bng).[3] Ziel des Registers ist unter anderem, anhand der gesammelten Informationen die Versorgung der Patienten weiter zu optimieren.

Literatur
-
Aktuelle Fachinformation Olysio®
-
Lawitz E et al. Simeprevir plus sofosbuvir with/without ribavirin for treating chronic 1 HCV genotype 1 infection in prior null-responders to 2 peginterferon/ribavirin and treatment-naïve patients (COSMOS: a randomised study). Lancet 2014, online publiziert am 28.07.2014
-
Pressemitteilung der Deutschen Leberstiftung vom 15.10.14 http://www.deutsche-leberstiftung.de/aktuelles/presseportal/pressearchiv/Pressemeldung_Register
Über Janssen
Als forschendes Pharmaunternehmen sind wir angetreten, die größten medizinischen Probleme unserer Zeit zu lösen. Im Schulterschluss mit Partnern weltweit entwickeln wir innovative Medikamente und Behandlungskonzepte, die optimal auf die Lebenssituation von Patienten eingehen. Schwerpunkte unserer Arbeit sind Onkologie, Immunologie, Neurologie/Psychiatrie, Infektiologie sowie Herz-Kreislauf- und Stoffwechselerkrankungen. Bei allem, was wir tun, verfolgen wir ein Ziel: lebensbedrohliche und chronische Krankheiten zu lindern oder zu heilen. Janssen ist die Pharmasparte von Johnson & Johnson, einem der weltweit führenden Gesundheitsunternehmen. In Deutschland beschäftigt die Janssen-Cilag GmbH mit Hauptsitz in Neuss rund 800 Mitarbeiter und erwirtschaftete 2013 einen Umsatz von 936 Millionen Euro (Quelle: IMS Health).
-
Mehr Informationen unter: www.janssen-deutschland.de
Anmerkungen
-
* Simeprevir in Kombination mit Sofosbuvir sollte nur bei Patienten angewendet werden, bei denen Interferon nicht geeignet ist oder die es nicht vertragen und bei denen eine Behandlung dringend ist. Basierend auf der klinischen Bewertung des einzelnen Patienten kann Ribavirin hinzugefügt werden.
-
** Gemäß Fachinformation: Vortherapie mit Interferon (pegyliert oder nicht pegyliert) mit oder ohne Ribavirin – Die Nullresponse ist definiert als ein Abfall der Viruslast um < 2log10 Stufen bis Woche 12 der Therapie.
Quelle: Janssen-Cilag, 20.11.2014 (tB).