MEDIZIN
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
FSME-Impfprophylaxe wird komfortabler und flexibler – bei Kindern und Erwachsenen
Von Dr. Eckhardt Petri, Medical Affairs Novartis Behring, Marburg
 Frankfurt am Main (19. Februar 2009) – Einen verlässlichen Schutz gegen die Frühsommer-Meningoenzephalitis (FSME) bietet nur die aktive Schutzimpfung mit FSME-Impfstoffen wie Encepur. Encepur-Impfstoffe sind erhältlich als Kinderimpfstoff (zugelassen bis zum vollendeten 12. Lebensjahr) und als Erwachsenen-Impfstoff. Die optimale Konzentration (im Sinne hoher Wirksamkeit bei bester Verträglichkeit) an Impfantigen für die jeweilige Altersgruppe wurde in frühen Dosisfindungsstudien ermittelt.
Frankfurt am Main (19. Februar 2009) – Einen verlässlichen Schutz gegen die Frühsommer-Meningoenzephalitis (FSME) bietet nur die aktive Schutzimpfung mit FSME-Impfstoffen wie Encepur. Encepur-Impfstoffe sind erhältlich als Kinderimpfstoff (zugelassen bis zum vollendeten 12. Lebensjahr) und als Erwachsenen-Impfstoff. Die optimale Konzentration (im Sinne hoher Wirksamkeit bei bester Verträglichkeit) an Impfantigen für die jeweilige Altersgruppe wurde in frühen Dosisfindungsstudien ermittelt.
Encepur-Impfstoffe sind zugelassen zur Grundimmunisierung entweder in einem Standardschema (Impfungen an den Tagen 0, 1-3 Monate, 9-12 Monate) oder in einem Schnellschema (Impfungen an den Tagen 0, 7 und 21), wobei bei letzterem Schema die erste Auffrischung bereits nach 18 Monaten erfolgen sollte. Eine weitere Flexibilisierung in der Wahl des Impfschemas ist nun gegeben, da es zukünftig mit Encepur-Impfstoffen auch ohne Einschränkungen möglich ist, die zweite Impfung im Standardschema bereits 14 Tage nach der ersten Impfung durchzuführen. Die dritte Impfung – für eine vollständige Grundimmunisierung – folgt nach weiteren 9-12 Monaten. Damit verfügen die Encepur-Impfstoffe über die derzeit größtmögliche Wahlfreiheit in der Auswahl an zugelassenen Impfschemata, womit für den Arzt und den Patienten die Terminierung von Impfterminen erheblich komfortabler wird.
Die wesentliche, immunogene Komponente der Encepur-Impfstoffe, d.h. der Bestandteil des Impfstoffes, der den Schutz gegen FSME-Erkrankungen induziert, ist das sogenannte Envelope-Protein (E-Protein) auf der äußeren Virushülle. Neutralisierende Antikörper gegen dieses E-Protein sind in der Lage die Virusvermehrung in vitro und in vivo effizient zu verhindern. Dementsprechend wird angenommen, dass ein hoher Spiegel neutralisierender Antikörper (nach erfolgter Impfung), die man idealer Weise ex-Vivo in einem funktionellen Virusneutralisationstest bestimmt, einen Schutz gegen die FSME-Erkrankung vermittelt. Als ein verlässliches Korrelat für einen bestehenden Impfschutz haben sich schützende Antikörpertiter in Höhe von NT > 10 erwiesen, d.h. konkret eine 1 zu 10 Verdünnung des Patientenserums ist dabei in der Lage die Vermehrung des FSME-Virus in vitro und damit im übertragenen Sinne die Entstehung einer FSME-Erkrankung in vivo effektiv zu verhindern.
Studien mit Encepur lassen eine ausgezeichnete Immunogenität erkennen, über 98% der Geimpften entwickeln nach drei Impfungen schützende Antikörper. Auch unter Verwendung des zugelassenen Schnellschemas und dem ersten Booster nach 18 Monaten wurde weitere ein bis zwei Jahre später nur eine geringe Antikörper – Abklingrate beobachtet. Bei mehr als 99% der mit Encepur Geimpften lag der NT-Titer dann immer noch deutlich über 10.
Dies ließ bereits vermuten, dass es nicht unbedingt erforderlich sein würde, einen weiteren Booster bereits drei Jahre nach der ersten Auffrischung mit Encepur zu verabreichen. Dass die Anzahl der Vorimpfungen (mindestens eine abgeschlossene Grundimmunisierung) dabei maßgeblich die Persistenz virus-neutralisierender Antikörper beeinflusst, wurde deutlich.
Basierend auf den Erkenntnissen einer Metaanalyse mehrerer Studien aus Österreich, der Schweiz, der Tschechischen Republik sowie aus Deutschland gilt daher heute für Erwachsene bis zur Vollendung des 50. Lebensjahres nach mindestens vier Impfdosen (Grundimmunisierung plus einen Booster drei Jahre nach der vollständigen Grundimmunisierung) ein Auffrischungsintervall mit Encepur von fünf Jahren. Personen ab dem 51. Lebensjahr sollten jedoch weiterhin in einem Drei-Jahresintervall eine Auffrischungsimpfung erhalten, da in der Regel von einem nachlassenden Immunsystem des Geimpften ausgegangen werden muss.
Nun liegen auch Echtzeitdaten für einen Beobachtungszeitraum von 5 Jahren nach Grundimmunisierung und einer Booster-Impfung vor. In kürzlich abgeschlossenen Beobachtungsstudien (n= 222 Erwachsene und n =190 Kinder) konnte aufgezeigt werden, dass nahezu alle Geimpften nach einer Auffrischungsimpfung mit Encepur auch noch 5 Jahre später über schützende Antikörpertiter (NT>10) verfügen. Damit wird deutlich, dass Virus-neutralisierende Antikörpertiter von NT>10 nach Impfung mit Encepur® – Impfstoffen wesentlich länger bestehen als früher angenommen.
Die ausgezeichnete Immunogenität von Encepur-Impfstoffen wurde jüngst auch in einer vergleichenden Studie bei Kindern belegt. Während nach einer begonnenen Immunisierung (zwei Impfdosen im Standardimpfschema) die mit Encepur geimpften Kinder ganzjährig über schützende Antikörpertiter (NT>10) verfügten, war dies bei den Kindern, die mit dem Wettbewerbsimpfstoff geimpft wurden, nur bei etwa 40% der Fall. Auch diese Kinder erzielten dann durch eine dritte Impfung mit Encepur Kinder (Abschluss der Grundimmunisierung) hohe schützende Antikörper (NT>10).
Die kürzlich erfolgte Zulassung eines verlängerten Booster-Intervalls nach einer ersten Auffrischung mit Encepur® Kinder von drei auf fünf Jahre führt auch zu einer erheblichen Einsparung von Impfstoffen. Unter Verwendung von Encepur® Kinder können bei Kindern und Jugendlichen sowohl im Standardschema als auch im Schnellschema bei Einhaltung empfohlener Impfintervalle zwei (bzw. eine) Impfdosen im Vergleich zur Verwendung des Wettbewerbsimpfstoffes eingespart werden.
Es stellt sich die Frage, worauf die ausgezeichnete immunogene Wirkung von Encepur-Impfstoffen zurückgeführt werden kann. Möglicherweise ist der Verzicht auf humanes Serumalbumin (HSA) im Impfstoff vorteilhaft für dessen Immunogenität. HSA ist ein großes Plasmaprotein mit relativ vielen Bindungsstellen. Bei Verzicht von proteinhaltigen Stabilisatoren wie HSA steht vermutlich das in einem Impfstoff vorhandene Impfantigen vollständig für eine Immunisierung zur Verfügung, weil das in die Endformulierung eingebrachte Impfantigen dabei nicht durch den Stabilisator HSA abgebunden bzw. neutralisiert (Schwammeffekt) wird.
Ein Vergleich der Fachinformationen der im deutschen Markt erhältlichen FSME-Impfstoffe zeigt auf, dass im Gegensatz zum Wettbewerbsprodukt die Encepur-Impfstoffe ohne den Zusatz von menschlichen Plasmaproteinen hergestellt werden und daher – gemäß den Empfehlungen der EMEA und der WHO – auch kein humanes Serumalbumin (HSA) enthalten. Dadurch ist ferner das theoretische Risiko der Übertragung von Viren, die mit diesen Proteinen assoziiert sein können, ausgeschlossen. Der EMEA Empfehlung folgend sind daher heute die Formulierungen (fast) aller Impfstoffe im deutschen Markt frei von HSA.
Durch die jüngste Erweiterung der zugelassenen Impfschemata für Encepur® Kinder und für Encepur® Erwachsene sowie durch die Verlängerung der empfohlenen Booster-Intervalle bei Kindern bieten die Encepur-Impfstoffe in der täglichen Praxis für die Impfprophylaxe einer FSME einen wahrnehmbaren Zugewinn an Flexibilität, Sicherheit und Komfort.

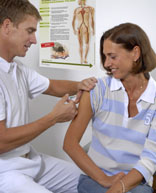
(Abb. oben: Sowohl zu Hause als auch auf Reisen: Eine Impfung ist der beste Schutz vor der FSME. Quelle: Novartis Behring)
Literatur
-
Zent O, TBE booster immunization according to the rapid immunization schedule: are 3-year booster intervals really necessary? Vaccine 23 (2004) 312-315.
-
Zent O, Henning R, Banzhoff A, Broeker M: Protection against Tick-Borne Encephalitis with a new vaccine formulation free of protein-derived stabilizers.J. Travel Med. 12 (2005) 85-93.
-
Rendi-Wagner P, Kundi M, Zent O, Dvorak G, Jaehnig P, Holzmann H, Mikolasek A, Kollarisch H: Persistence of protective immunity following vaccination against tick-borne encephalitis – longer than expected. Vaccine 22 (2004) 2743-2749.
-
Rendi-Wagner P, Zent O, Jilg W, Plentz A, Beran J, Kollaritsch H: Persistence of antibodies after vaccination against tick-borne encephalitis. IJMM 296 (2006) S1, 202-207.
-
Rendi-Wagner P, Paulke-Korinek M, Kundi M, Wiedermann U, Laaber B, Kollaritsch H: Antibody persistence following booster vaccination against tick-borne encephalitis: 3-Year post-booster follow up. Vaccine 25 (2007) 5097-5101.
-
Wittermann C, Schöndorf I, Gniel D: Antibody response following administration of two paediatric tick-borne encephalitis vaccines using two different vaccination schedules. Vaccine (2009), im Druck.
-
Wittermann C, Petri E, Zent O: Long-term persistence of tick-borne encephalitis antibodies in children 5 years after booster vaccination with Encepur® children. Vaccine (2009), im Druck.
-
Broeker M, Zent O: A tick-borne encephalitis vaccne without human serum albumin as stabilizer. Letter to the editor. Vaccine 23 (2005) 5699
-
Plentz et al.: Long-term persistence of tick-borne encephalitis antibodies in adults 5 years after booster vaccination with Encepur® adults. Vaccine (2009), im Druck.
Referent
Dr. Eckhardt Petri
Medical Affairs Manager
Novartis Vaccines and Diagnostics GmbH & Co. KG.
Emil-von-Behring-Str. 76
35041 Marburg
email: Eckhardt.Petri@novartis.com
Dowbload
Folien zurm ![]() Referat Dr. Eckardt Petri.pdf (854.90 KB)
Referat Dr. Eckardt Petri.pdf (854.90 KB)
Quelle: Pressekonferenz der Firma Novartis Behring zum Thema “FSME-Saison 2009: Deutliche Verbesserungen bei der Impfprophylaxe“ am 19.02.2009 in Frankfurt am Main (Weber Shandwick).