MEDIZIN
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Eisenmangel bei chronisch-entzündlichen Darmerkrankungen erhöht den Leidensdruck der Patienten
- Bis zu 80 % der Patienten mit chronisch-entzündlichen Darmerkrankungen (CED) weisen einen Eisenmangel auf, etwa ein Drittel ist anämisch.1 Für die Patienten kann dies eine erhebliche Erhöhung des Leidensdrucks und eine Einbuße an Lebensqualität bedeuten.2,3
- Aktuelle Leitlinien raten, CED-Patienten auf das Vorliegen eines Eisenmangels4,5 und einer Anämie2,4,5 hin zu untersuchen. Eine wichtige Rolle spielt hierbei die Bestimmung der Transferrinsättigung (TSAT).2
- Bei Vorliegen einer Eisenmangelanämie wird explizit die Substitution mit Eisen empfohlen2,4,5, die auch bereits bei isoliertem Eisenmangel sinnvoll sein kann.6 Wichtig ist eine frühzeitige Behandlung.
- Evidenzbasierte Studiendaten zeigen den klinischen Nutzen einer intravenösen (i.v.) Eisentherapie mit Eisencarboxymaltose (ferinject®)* bei CED-Patienten mit Eisenmangel(-Anämie)7-10, einschließlich Verbesserungen der Lebensqualität (körperliche Funktionsfähigkeit und psychisches Wohlbefinden)**,8.
München (9. Juni 2020) — Eisenmangel ist keine Seltenheit bei gastroenterologischen Erkrankungen: Zwischen 60 % und 80 % der Patienten mit chronisch-entzündlichen Darmerkrankungen (CED), wie Morbus Crohn und Colitis ulcerosa, leiden an einem Eisenmangel und etwa ein Drittel ist anämisch.1 Die Anämie stellt die häufigste systemische Komplikation und extraintestinale Manifestation bei CED dar2; in bis zu 90 % der Fälle wird sie durch ein Eisendefizit verursacht.11 Daher sollten CED-Patienten regelmäßig hinsichtlich eines Eisenmangels überwacht und adäquat behandelt werden, wie Dr. Thomas Klag, niedergelassener Gastroenterologe aus Stuttgart, im Rahmen der digitalen Veranstaltung „Inside Medicine“ von Vifor Pharma darstellte.
Eisenmangel bei CED-Patienten: Was steckt dahinter?
CED-assoziierter Eisenmangel ist multifaktoriell bedingt. Zu den Ursachen zählen kontinuierlicher Blutverlust durch Ulzerationen der Darmschleimhaut, Malnutrition mit verminderter Eisenaufnahme und/oder verminderte Resorption über die geschädigte Darmmukosa.2 Ein weiterer Faktor ist der sogenannte „Hepcidin-Block“: Bei entzündlichen Erkrankungen wird die Synthese des Peptidhormons Hepcidin in der Leber stimuliert. Hepcidin bewirkt einen Abbau der Ferroportin-Kanäle in den Darmzellen und Makrophagen, sodass die Eisenfreisetzung aus den Speichern und die Eisenaufnahme im Dünndarm deutlich verringert werden. Dadurch steht dem Körper nicht genügend Eisen zur Verfügung.12 In der Folge können sich zunächst ein Eisenmangel und schließlich eine Anämie entwickeln. Man spricht dann von einer Anämie der chronischen Erkrankung.11,12
Für das Patientenwohl: Eisendefizit frühzeitig diagnostizieren und behandeln
Aufgrund der zahlreichen Funktionen von Eisen im Körper, zeigt ein Eisenmangel vielgestaltige Auswirkungen, welche die Patienten im Alltag stark beeinträchtigen können. Mögliche Symptome sind Erschöpfung, Fatigue sowie kognitive Einschränkungen.11 Da Symptome wie Fatigue und eingeschränkte Konzentrationsfähigkeit auch häufige Begleiter von CED sind, besteht die Gefahr, dass der Eisenmangel beim Patienten übersehen wird.13 Bleibt der Eisenmangel unbehandelt, kann der Weg in die Eisenmangelanämie führen. 14 (Abb.1) Diese Entwicklung gilt es zu verhindern, denn die Eisenmangelanämie kann bei den ohnehin krankheitsbedingt belasteten Patienten mit einer Reduktion der Lebensqualität verbunden sein und ist zudem mit erhöhten Hospitalisierungsraten assoziiert.2
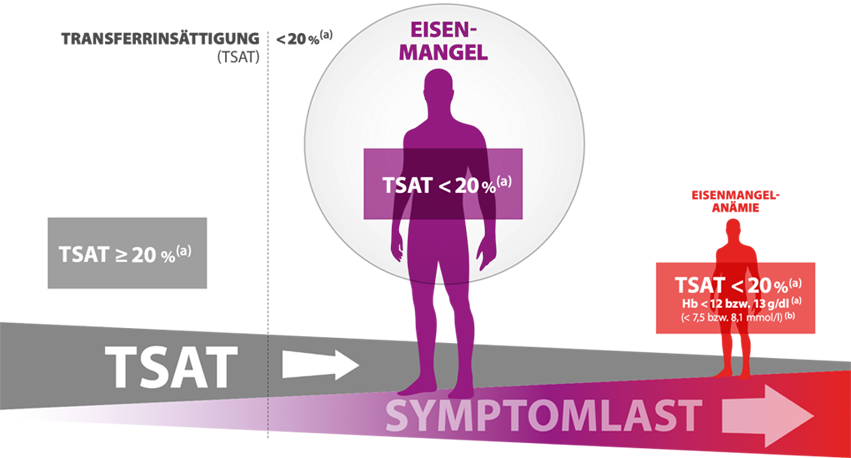
Abb. 1: Eisenmangel behandeln – Anämie vermeiden
[a] Dignass AU et al. J Crohns Colitis 2015;9(3):211–222, [b] Herold G. Innere Medizin 2018; Selbstverlag; 31.
Klare Empfehlungen der Leitlinien zur Diagnostik und Therapie
Die Konsensusguideline der European Crohn’s and Colitis Organisation (ECCO)2 sowie die S3-Leitlinien4,5 der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) zeigen das Vorgehen zur Diagnostik sowie zur Behandlung von Eisenmangel(-Anämie) bei CED-Patienten auf. So sollte bereits initial eine Blutbilddiagnostik vorgenommen werden, die die Kontrolle des Eisenhaushaltes einschließt.4,5 Eisenmangel oder -Anämie sind anhand weniger Laborparameter festzustellen: Neben dem Blutbild sind insbesondere Transferrinsättigung (TSAT), Serum-Ferritin, C-reaktives Protein (CRP) und Hämoglobin (Hb) entscheidende Parameter.11 Dabei stellt die TSAT als Parameter für die Versorgung wichtiger eisenabhängiger Funktionen, wie z.B. der Erythropoese12, einen entscheidenden diagnostischen Parameter für die Bestimmung des Eisenmangels dar11. Die Diagnose eines Eisendefizits bei CED ist abhängig vom Entzündungsgrad definiert: Für Patienten ohne klinische, endoskopische oder biochemische Anzeichen für eine aktive CED gilt ein Serum-Ferritin-Wert von < 30 μg/l als Kriterium für Eisenmangel. Bei aktivem Verlauf weist auch eine Konzentration zwischen 30–100 µg/l auf ein Eisendefizit hin. Liegt die TSAT < 20 % bei gleichzeitigem Serum-Ferritin > 100 µg/l, ist dies indikativ für eine Anämie der chronischen Erkrankung.2
Der ECCO-Konsensus empfiehlt bei allen CED-Patienten mit manifester Eisenmangelanämie die Eisensubstitution.2 Diese kann jedoch auch bereits bei isoliertem Eisenmangel sinnvoll sein.6 Ziel der Therapie ist das Auffüllen der Eisenspeicher und die Normalisierung des Hämoglobin (Hb)-Wertes2 und folglich die Reduktion der Symptomlast, die durch das Eisendefizit verursacht wird. (Abb. 1) Jedoch erhalten trotz der Therapieempfehlungen etwa 50 % der CED-Patienten mit Eisenmangelanämie keine Substitution.15
i.v. oder oral: egal?
Generell stehen orale und i.v. Eisenpräparate* zur Verfügung. Die ECCO empfiehlt eine i.v. Eisengabe bei CED-Patienten mit klinisch aktiver Erkrankung, Unverträglichkeit von oralem Eisen, bei Hb-Werten < 10 g/dl sowie bei Therapien mit Erythropoese-stimulierenden Agentien.2 Ähnliche Empfehlungen enthalten die aktuellen S3-Leitlinien zur Behandlung von Colitis ulcerosa4 bzw. M. Crohn5. Sie nennen zusätzlich Nichtansprechen auf orales Eisen4,5 oder auch die Patientenpräferenz4 als Indikationen für eine i.v.-Eisengabe. Mögliche Limitierungen der oralen Therapie sind beispielsweise die tägliche Einnahme sowie die lange Anwendungsdauer (Compliance), ebenso wie mögliche gastrointestinale Unverträglichkeiten.16 Es gibt Hinweise darauf, dass sie auch zur Verschlechterung der Krankheitsaktivität beitragen kann.13 Darüber hinaus kann die orale Eisensubstitution speziell bei CED-Patienten durch verminderte Resorption über die geschädigte Darmmukosa2 und den Hepdicin-Block beeinträchtigt sein12.
Demgegenüber kann eine i.v. Eisentherapie* den Hepcidin-Block umgehen12 und wird von CED-Patienten mit Unverträglichkeit gegenüber oralem Eisen im Allgemeinen besser vertragen17. Einer Befragung von 631 CED-Patienten zufolge führte sie zudem zu mehr Lebensqualität und Zufriedenheit.14
Eisen ist nicht gleich Eisen: Charakteristika der Eisencarboxymaltose
Die i.v. Eisenpräparate haben unterschiedliche Charakteristika. Eisencarboxymaltose (ferinject®)* – mit über 12 Jahren Erfahrung seit der Zulassung18 – konnte eine signifikante Wirksamkeit gegenüber oralem Eisen zeigen#,17. Durch die hohe Komplexstabilität und die kontrollierte Eisenaufnahme zeigt sie sich verträglich.19 Eisencarboxymaltose ist dextranfrei20 und lässt sich in einer Dosis von bis zu 1.000 mg pro Applikation über einen kurzen Zeitraum (15 Min. Applikation + 30 Min. Nachbeobachtung) verabreichen18.
Evidenzbasierte, klinische Studiendaten belegen den Nutzen der Gabe von Eisencarboxymaltose bei CED-Patienten mit Eisenmangelanämie7-10 – sowohl im Vergleich zu Placebo7 als auch zu i.v. Eisensucrose8. Eisencarboxymaltose i.v. führte innerhalb von 12 Wochen bei einem Großteil der Patienten zur Normalisierung der Hb-Werte und zu einer Verbesserung der Lebensqualität.**,8 Des Weiteren ist unter Eisencarboxymaltose i.v eine nachhaltige Symptomverbesserung möglich7,8.
Die Vifor Pharma Gruppe, ehemals Galenica Gruppe, ist ein globales Spezialitäten-Pharmaunternehmen. Sie hat sich zum Ziel gesetzt, globale Marktführerin in den Bereichen Eisenmangel, kardio-renaler Therapien und Nephrologie zu werden. Das Unternehmen ist der bevorzugte Partner für Spezialitäten-Pharmaprodukte und innovative patientenorientierte Lösungen. Die Vifor Pharma Gruppe will Patienten mit schweren und chronischen Krankheiten auf der ganzen Welt helfen, ein Leben in besserer Gesundheit zu führen. Das Unternehmen entwickelt, produziert und vermarktet pharmazeutische Produkte für eine optimale Patientenversorgung. Die Vifor Pharma Gruppe nimmt in all ihren Kerngeschäften eine führende Position ein und besteht aus den folgenden Unternehmen: Vifor Pharma, Vifor Fresenius Medical Care Renal Pharma (ein gemeinsam mit Fresenius Medical Care geführtes Unternehmen), Relypsa und OM Pharma. Die Vifor Pharma Gruppe hat ihren Hauptsitz in der Schweiz und ist an der Schweizer Börse (SIX Swiss Exchange, VIFN, ISIN: CH0364749348) kotiert.
- Weitere Informationen finden Sie auf www.viforpharma.com.
Vifor Pharma, ein Unternehmen der Vifor Pharma Gruppe mit Sitz in Zürich, ist die weltweit führende Gesellschaft in der Erforschung, Entwicklung, Herstellung und Vermarktung von pharmazeutischen Produkten zur Behandlung von Eisenmangel. Das Unternehmen bietet zudem ein diversifiziertes Portfolio an verschreibungs- (Rx) und nichtverschreibungspflichtigen (OTC) Medikamenten an.
Vifor Pharma baut seine globale Präsenz laufend aus und verfügt über ein umfassendes, weltweites Netzwerk aus Tochtergesellschaften und Partnern.
- Weitere Informationen über Vifor Pharma finden Sie auf www.viforpharma.com.
ferinject® (US-Markenname: Injectafer®) ist ein innovatives, dextranfreies, intravenös zu verabreichendes Eisenpräparat, das von Vifor Pharma erforscht und entwickelt wurde. Eisencarboxymaltose ist der pharmazeutische Wirkstoff von ferinject®. Bislang ist ferinject® in 72 Ländern weltweit für die Behandlung von Eisenmangelzuständen zugelassen, wenn orale Eisenpräparate unwirksam sind oder nicht angewendet werden können. Die Diagnose eines Eisenmangels muss durch geeignete Laboruntersuchungen bestätigt sein.
FERINJECT® 50 mg Eisen/ml.
Wirkstoff: Eisencarboxymaltose.
Zusammensetzung: 1 ml Lösung enthält 50 mg elementares, dreiwertiges Eisen als Eisencarboxymaltose; sonstige Bestandteile: Natriumhydroxid und Salzsäure (zur Einstellung des pH-Werts), Wasser für Injektionszwecke. Anwendungsgebiete: Behandlung von Eisenmangelzuständen, wenn orale Eisenpräparate unwirksam sind oder nicht angewendet werden können. Die Diagnose eines Eisenmangels muss durch geeignete Laboruntersuchungen bestätigt sein.
Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff, gegen Ferinject® 50 mg Eisen/ml oder einen der sonstigen Bestandteile, schwere bekannte Überempfindlichkeit gegen andere parenterale Eisenpräparate, nicht durch Eisenmangel bedingte Anämie, Anhaltspunkte für eine Eisenüberladung oder Eisenverwertungsstörungen.
Nebenwirkungen: Häufig: Hypophosphatämie, Kopfschmerzen, Schwindel, Flush, Hypertonie, Übelkeit, Reaktionen an der Injektions-/infusionsstelle. Gelegentlich: Überempfindlichkeit, Parästhesie, Dysgeusie, Tachykardie, Hypotonie, Dyspnoe, Erbrechen, Dyspepsie, Abdominalschmerz, Verstopfung, Diarrhoe, Pruritus, Urtikaria, Erythem, Ausschlag, Myalgie, Rückenschmerzen, Arthralgie, Schmerz in einer Extremität, Muskelspasmen, Fieber, Müdigkeit, Schmerzen im Brustkorb, peripheres Ödem, Schüttelfrost, vorübergehender Abfall der Serumphosphatspiegel, Anstieg der Alanin-Aminotransferase, Anstieg der Aspartat-Aminotransferase, Anstieg der Gamma-Glutamyltransferase, Anstieg der Lactatdehydro-genase im Blut, Anstieg der alkalischen Phosphatase im Blut. Selten: anaphylaktoide/anaphylaktische Reaktionen, Verlust des Bewusstseins, Angst, Phlebitis, Synkope, Präsynkope, Bronchospasmen, Flatulenz, Angioödem, Blässe, Gesichtsödem, Unwohlsein, grippeähnliche Symptome (die innerhalb weniger Stunden oder mehrerer Tage einsetzen können).
Verschreibungspflichtig.
Pharmazeutischer Unternehmer: Zulassungsinhaber: Vifor France, 100-101 Terasse Boieldieu, Tour Franklin La Défense 8, 92042 Paris La Défense Cedex, Frankreich; Vertrieb: Vifor Pharma Deutschland GmbH, Baierbrunner Straße 29, 81379 München, Deutschland. Stand: November 2018
Anmerkungen
* ferinject® ist indiziert zur Behandlung von Eisenmangelzuständen, wenn orale Eisenpräparate unwirksam sind oder nicht angewendet werden können.18
** Die Lebensqualität war ein sekundärer Endpunkt in der prospektiven, randomisierten, klinischen Studie FERGICOR bei Patienten mit Eisenmangel-Anämie und milder bis moderater chronisch entzündlicher Darmerkrankung (CED) bzw. CED in Remission, gemessen anhand der standardisierten Fragebögen Health Survey Short Form (SF-36, Fragebogen mit 36 Items zur Erfassung der gesundheitsbezogenen Lebensqualität), Version 2 und Inflammatory Bowel Disease Questionnaire (IBDQ) von Baseline zu Woche 12. Die krankheitsbezogene (IBDQ) sowie die körperliche und mentale Lebensqualität (SF-36) verbesserte sich signifikant über die Studiendauer von 12-Wochen (p jeweils < 0,001).8
# Gegenüber oralem Eisen(II)-sulfat (Metaanalyse aus 5 randomisierten, kontrollierten Studien mit 1.143 CED-Patienten).17
Literatur
- Stein J, Dignass AU. Management of iron deficiency anemia in inflammatory bowel disease – a practical approach. Ann Gastroenterol 2013; 26: 104–113.
- Dignass AU, et al. European Consensus on the Diagnosis and Management of Iron Deficiency and Anaemia in Inflammatory Bowel Diseases. J Crohns Colitis 2015; 9: 211–222.
- Cappellini MD, et al. Iron deficiency across chronic inflammatory conditions: International expert opinion on definition, diagnosis, and management. Am J Hematol 2017; 92: 1068–1078.
- Kucharzik T, et al. S3-Leitlinie – Colitis ulcerosa. Mai 2018. AWMF-Registernr. 021–009.
- Preiß JC, et al. Aktualisierte S3-Leitlinie „Diagnostik und Therapie des M. Crohn“ 2014. AWMF-Registernr. 021/004.
- Gomollón F, Gisbert JP. Current management of iron deficiency anemia in inflammatory bowel diseases: A practical guide. Drugs 2013; 73: 1761–1770.
- Evstatiev R, et al. Ferric carboxymaltose prevents recurrence of anemia in patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2013; 11: 269–277. (Randomisierte, Plazebo-kontrollierte, multizentrische, einfach verblindete Studie)
- Evstatiev R, et al. FERGIcor, a randomized controlled trial on ferric carboxymaltose for iron deficiency anemia in inflammatory bowel disease. Gastroenterol 2011; 141: 846–853. (Prospektive, randomisierte klinische Studie)
- Kulnigg S, et al. Novel intravenous iron formulation for treatment of anemia in inflammatory bowel disease: the ferric carboxymaltose (FERINJECT®) randomized controlled trial. Am J Gastroenterol 2008; 103: 1182–1192. (Multizentrische, randomisierte, kontrollierte, Open-Label-Studie)
- García-Lopez S, et al. High-dose intravenous treatment in iron deficiency anaemia in inflammatory bowel disease: early efficacy and impact on quality of life. Blood Transfus 2016; 14: 199–205.
- Reinisch W, et al. State of the iron: How to diagnose and efficiently treat iron deficiency anemia in inflammatory bowel disease. J Crohns Colitis 2013; 7: 429–440.
- Metzgeroth G, Hastka J. Eisenmangelanämie und Anämie der chronischen Erkrankung. Internist 2015; 56: 978–988.
- Niepel D, et al. Practical guidance for the management of iron deficiency in patients with inflammatory bowel disease. Ther Adv Gastroenterol 2018; 11: 1–16.
- Danese S, et al. Anaemia from a patient perspective in inflammatory bowel disease: results from the European Federation of Crohn’s and Ulcerative Colitis Association’s online survey. Eur J Gastroenterol Hepatol 2014; 26(12): 1385–1391.
- Blumenstein I, et al. Current practice in the diagnosis and management of IBD-associated anaemia and iron deficiency in Germany: The German AnaemIBD Study. J Crohn Colitis 2014; 8(10): 1308–1314. (Nicht-interventionelle, retrospektive, multizentrische Studie)
- Hastka J et al. Eisenmangel und Eisenmangelanämie. Stand Dezember 2018. Online verfügbar unter https://www.onkopedia.com/de/onkopedia/guidelines/eisenmangel-und-eisenmangelanamie/@@view/html/
index.html (Letzter Zugriff 12.05.2020). - Aksan A, et al. Systematic review with network meta-analysis: comparative efficacy and tolerability of different intravenous iron formulations for the treatment of iron deficiency anaemia in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2017; 45: 1303–1318. (Metaanalyse)
- Fachinformation ferinject®, in der jeweils gültigen Fassung.
- Geisser P. The pharmacology and safety profile of ferric carboxymaltose (Ferinject®): structure/reactivity relationships of iron preparations. Port J Nephrol Hypert 2009; 23(1):11–16. (Zusammenstellung nicht-klinischer, präklinischer und klinischer Daten)
- Neiser S, et al. Assessment of dextran antigenicity of intravenous iron preparations with enzyme-linked immunosorbent assay (ELISA). Int J Mol Sci. 2016; 17(7): 1185.
Quelle: Vifor Pharma, 09.06.2020 (tB).
Schlagwörter: Chronisch-entzündliche Darmerkrankung, Eisenmangel, Vifor


