MEDIZIN
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
FAIR-HF-Studie:
Ferinject® verbessert signifikant Symptome und Lebensqualität bei chronischer Herzinsuffizienz
Frankfurt (1. Dezember 2009) – Erstmals nach vielen Jahren eröffnet die kürzlich abgeschlossene FAIR-HF-Studie eine neue Option für die Therapie von Patienten mit chronischer Herzinsuffizienz. Die Studie hat ergeben, dass eine intravenöse Eisensubstitution mit Ferinject® (Eisencarboxymaltose) bei Patienten, die zusätzlich unter einem Eisenmangel litten, sowohl die Symptome, die körperliche Belastbarkeit sowie die Lebensqualität signifikant verbessert. Die Ergebnisse wurden am 17. November im Rahmen der „Late-Breaking Clinical Trials Sessions“ 2009 der American Heart Association in Orlando, USA, bekannt gegeben und zeitgleich online im New England Journal of Medicine publiziert. (1) Heute wurden sie bei einer Meet-the-Expert-Session in Deutschland vorgestellt. Dank der positiven Resultate der FAIR-HF-Studie steht Ärzten eine neue, gut verträgliche Behandlungsmöglichkeit sofort zur Verfügung, um die Symptome und die Lebensqualität von Patienten mit chronischer Herzinsuffizienz und Eisenmangel (mit und ohne Anämie) zu verbessern.
Die chronische Herzinsuffizienz ist die vierthäufigste Todesursache in Deutschland. Die Erkrankung nimmt in der Regel einen aggressiven Verlauf und ein wichtiges therapeutisches Ziel ist eine möglichst lange Funktionserhaltung des Patienten. Trotz intensiver Forschungen gab seit fast zehn Jahren keine nennenswerte Fortschritte in diesem Bereich. Die Ergebnisse der aktuell vorgestellten FAIR-HF-Studie geben nun Patienten mit chronischer Herzinsuffizienz und Eisenmangel, die unter den Symptomen der Erkrankung und einer eingeschränkten Lebensqualität leiden, begründeten Anlass zur Hoffnung auf rasche Besserung. Bei FAIR-HF (Ferinject® Assessment in patients with IRon deficiency and chronic Heart Failure) handelt es sich um eine groß angelegte, multizentrische, randomisierte, doppelblinde, placebokontrollierte Phase-III-Studie mit Patienten mit chronischer Herzinsuffizienz und Eisenmangel (mit und ohne Anämie). Es wurde untersucht, ob die Korrektur von Eisenmangel mit intravenösem Eisen (Ferinject®, Eisencarboxymaltose) eine Verbesserung des Gesundheitszustandes bei Patienten mit symptomatischer chronischer Herzinsuffizienz und systolischer Dysfunktion mit und ohne Anämie bewirkt. FAIR-HF erreichte die beiden primären Endpunkte im Vergleich zur Kontrollgruppe (Placebo): die sogenannte „Self-Reported Patient Global Assessment (PGA) Auswertung“ und die „New York Heart Association-(NYHA)-Klasse“. Beide Endpunkte wiesen statistisch signifikante Vorteile für Ferinject® auf. Da das Präparat bereits seit zwei Jahren auf dem deutschen Markt erhältlich ist, bestehen bereits umfangreiche Erfahrungen in der Anwendung. Die Therapie kann daher sofort von jedem Kardiologen angewendet werden.
Die Einzelheiten der Studienergebnisse wurden im Rahmen der „Late-Breaking Clinical Trials Sessions“ 2009 der American Heart Association in Orlando (USA) präsentiert. Prof. Stefan Anker, Professor für Kardiologie und Kachexieforschung, Fakultät für Kardiologie, Charité, Universitätsmedizin in Berlin und Leiter der FAIR-HF-Studie erklärte: „Unsere Ergebnisse zeigen, dass die 24 Wochen dauernde Behandlung von Eisenmangel mit intravenöser Eisencarboxymaltose die Symptome bei Patienten mit chronischer Herzinsuffizienz mit und ohne Anämie verbessert. Dies ist bemerkenswert, da schon seit vielen Jahren keine Studie mit einem neuen Medikament solch eine markante symptomatische Verbesserung bei der Behandlung von Patienten mit chronischer Herzinsuffizienz ergab.“
Bereits ab der 4. Studienwoche und über die gesamte Laufzeit der Studie hinweg schätzten Patienten, die mit Ferinject® behandelt worden waren, ihre Lebensqualität höher ein als jene, die ein Placebo erhalten hatten (p < 0,001). Neben den Symptomen verbesserte Ferinject® sowohl die körperliche Funktionsfähigkeit, die anhand von 6-Minuten-Gehtests gemessen wurde, wie auch die Lebensqualität und wurde zudem gut vertragen.
Studienergebnisse
459 Patienten mit chronischer Herzinsuffizienz und Eisenmangel (mit oder ohne Anämie) wurden in 75 Studienzentren auf der ganzen Welt untersucht. Zwei Drittel der Patienten erhielten wöchentlich 200 mg Ferinject®, bis der Eisenmangel korrigiert war. Danach 200 mg monatlich bis zur 24. Woche (Erhaltungsphase). Die anderen Patienten erhielten ein Placebo.
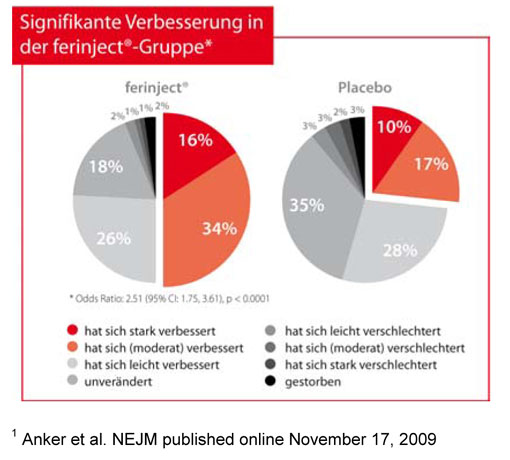
Die mit Ferinject® behandelten Patienten zeigten eine signifikante Verbesserung in den beiden primären Endpunkten der Studie. Gemessen wurden die Lebensqualität der Patienten mittels der PGA nach 24 Wochen (p < 0,0001) und die NYHA-Klasse, ein Maßstab zur Ermittlung des Schweregrads der Herzinsuffizienz (p < 0,0001). In Bezug auf den PGA-Endpunkt wiesen 50% der Patienten, die Eisencarboxymaltose erhielten, in der 24. Studienwoche eine „große“ oder „moderate Verbesserung“ auf – im Vergleich zu nur 28% der Patienten in der Placebogruppe. Im Hinblick auf die NYHA-Klassifikation wurden 47% der mit Eisencarboxymaltose behandelten Patienten in der 24. Woche in die NYHA-Klasse I oder II eingestuft, gegenüber nur 30% der Patienten, die ein Placebo erhielten.
Auch bei den sekundären Endpunkten waren die Ergebnisse hochsignifikant: Nach 24 Wochen verbesserten sich Patienten, denen Ferinject® verabreicht worden war, im 6-Minuten-Gehtest um
39 Meter hinsichtlich der Baseline, im Vergleich zu rund 9 Metern in der Placebogruppe (p < 0,001). Die Differenz zwischen der mit Ferinject® behandelten Gruppe und der Placebogruppe betrug in der 24. Studienwoche insgesamt 35 Meter. Die Sterblichkeitsrate und die Häufigkeit von unerwünschten Ereignissen waren in beiden Testgruppen ähnlich. Die Zahl der Rehospitalisierungen wiesen einen niedrigeren Trend in der Ferinject®-Gruppe auf.
Über Ferinject®
Ferinject® ist ein innovatives, intravenös zu verabreichendes Eisenpräparat aus der eigenen Forschungs-und Entwicklungsabteilung von Vifor Pharma. Ferric Carboxymaltose, der Wirkstoff von Ferinject®, erfüllt klinische Bedürfnisse in der intravenösen Eisentherapie. Anders als bei Dextran-Eisenpräparaten, die mit anaphylaktischen Reaktionen assoziiert sind, ist Ferinject® Dextran-frei und weist zudem ein niedriges Potenzial für toxische Reaktionen auf. Ferinject® kann in hohen Dosen und in kurzer Zeit verabreicht werden.
Bislang ist Ferinject® in 18 europäischen Ländern und in der Schweiz für die Behandlung von Eisenmangel zugelassen, wenn orales Eisen unwirksam ist oder nicht angewendet werden kann. Intravenöse Eisenpräparate werden in vielen Ländern hauptsächlich für die Behandlung von Dialyse-Patienten eingesetzt. Eisenmangel ist aber auch in anderen Krankheiten eine Begleitdiagnose, was ein großes Marktpotenzial für Eisenpräparate von Vifor Pharma darstellt. Der fortlaufende Aufbau von wissenschaftlichen Erkenntnissen über den Einsatz von Ferinject® außerhalb des Therapiegebietes der Dialyse hat deshalb oberste Priorität. Vifor Pharma wird neue Möglichkeiten in der Behandlung von Eisenmangel mit Ferinject® in verschiedenen Therapiebereichen evaluieren. Untersuchungen mit Ferinject® bei chronischer Niereninsuffizienz (CKD), in der Onkologie (Anämie bei Krebspatienten), in der Gastroenterologie (entzündliche Darmerkrankung), Chirurgie (präoperative Anämie) und Gynäkologie sind bereits angelaufen oder geplant.
Vifor Pharma – zu der die Vifor Pharma Deutschland GmbH gehört – ist eine integrierte und spezialisierte Pharmagruppe, die pharmazeutische Spezialitäten erforscht, entwickelt, produziert und weltweit vermarktet. Sie konzentriert sich auf die Kernkompetenzen Anämie, Nephrologie und Consumer Health. Mit ihren parenteralen und oralen Eisenpräparaten ist Vifor Pharma weltweit marktführend bei den Medikamenten zur Behandlung von Eisenmangelerscheinungen. Im Bereich Consumer Health stellt Vifor Pharma eigene, lizenzierte oder vertretene Produkte im Rx- und OTC-Bereich her und vermarktet diese in der Schweiz und in ausgewählten Exportländern. Vifor Pharma ist ein Unternehmen der Galenica Gruppe.
Zusätzliche Informationen über Vifor Pharma finden Sie auf www.viforpharma.de
Zusätzliche Information über Galenica finden Sie auf www.galenica.com
Literatur
(1) N Engl J Med. 2009 Nov 17. [Epub ahead of print]
Abbildungen

Abb. 1: Patient Global Assessment nach 24 Wochen.

Abb. 2: NYHA-Klassifizierung nach 24 Wochen.

Abb. 3: 6-Minuten Gehtest.

Abb. 4: Anämie bei CHI.

Abb. 5: Eisenmangel & Mortalitätsrate bei CHI.

Abb. 6: Eisen & Herzinsuffizienz.

Abb. 7: Verbesserung LVEF.

Abb. 8: Inzidenz von Nebenwirkungen bei Ferinject®.

Abb. 9: Ferinject® – eine neue Dimension in der i.v. Eisentherapie.

Abb. 10: Packshot Ferinject®.

Abb. 11: Ferinject® Applikation.

Abb. 12: Der Eisenmetabolismus.
Quelle: Meet-the-expert-session der Firma Vifor Pharma zum Thema „Volle Eisenspeicher verbessern die Herzfunktion und die Lebensqualität – intravenöses Eisen als neue Therapieoption bei Herzinsuffizienz“ am 01.12.2010 in Frankfurt am Main (MWO) (tB).