MEDIZIN
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Guselkumab (Tremfya®)
Zulassung des ersten selektiven Interleukin-23 Hemmers für die Behandlung der mittelschweren bis schweren Plaque-Psoriasis
Neuss (23. November 2017) ‑ Die Europäische Kommission hat Guselkumab (Tremfya®) von Janssen für die Erstlinien-Behandlung von erwachsenen Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis zugelassen, die für eine systemische Therapie in Frage kommen.(1) Guselkumab ist der erste zugelassene Antikörper, der selektiv das regulierende Masterzytokin Interleukin (IL)-23 hemmt. Janssen stellt das Arzneimittel in Deutschland in Partnerschaft mit der Galderma Laboratorium GmbH zur Verfügung.
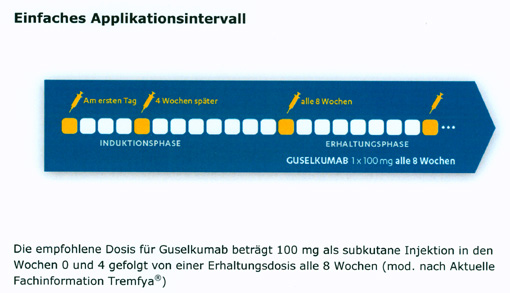
Guselkumab ist in Deutschland für die Behandlung von erwachsenen Patienten mit mittelschwerer bis schwerer Plaque‑Psoriasis zugelassen, die für eine systemische Therapie in Frage kommen. Guselkumab ist ein voll humaner, monoklonaler Antikörper und bindet selektiv an die p19 Untereinheit von IL-23. Guselkumab verhindert so die Bindung von IL‑23 an dessen Rezeptor.(2) Dadurch wird der IL-23Signalweg, der für die Proliferation und das Überleben von Th17-Zellen essentiell ist, geblockt.(3, 4, 5) Guselkumab ist der erste zugelassene Vertreter der Substanzklasse der IL-23 Hemmer. Die Therapie bietet ein einfaches Applikationsintervall: Im ersten Therapiejahr sind acht Injektionen notwendig. Die empfohlene Dosis für Guselkumab beträgt 100 mg als subkutane Injektion in den Wochen 0 und 4 gefolgt von einer Erhaltungsdosis alle 8 Wochen.(6)
Schnelle und starke Wirksamkeit
Grundlage für die Zulassung waren die doppelblinden, dreiarmigen Placebo- und Vergleichspräparat-kontrollierten Phase-III-Studien VOYAGE 1 (7) (n=837) und VOYAGE 2 (2) (n=994). In diesen wurde die Wirksamkeit und Verträglichkeit von Guselkumab mit Adalimumab sowie mit Placebo bei erwachsenen Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis verglichen. In allen Studien, bei allen Studienteilnehmern, war die klinische Wirksamkeit unabhängig vom Körpergewicht, der Vortherapie und der Plaque-Lokalisation gleichermaßen gut. In VOYAGE 1 zeigte sich ein klinisch relevantes Ansprechen von 96,4 % in Woche 48 bei den Patienten, die bis Woche 16 mit Placebo vorbehandelten wurden.(7) Die Patienten konnten auch von einem schnellen Wirkeintritt profitieren: Nach 24 Wochen (n=329) erreichten 91,2 % ein Psoriasis Area and Severity Index (PASI) 75-, 80,2 % ein PASI 90- und 44,4 % ein PASI 100-Ansprechen, was einer vollständigen Erscheinungsfreiheit entspricht.(7)
Sowohl in VOYAGE 1 als auch in VOYAGE 2 war Guselkumab in allen wesentlichen primären und sekundären Endpunkten Adalimumab deutlich überlegen (p<0,001).(2, 7) Bis Woche 24 lag der Anteil der Patienten mit einer fast vollständig erscheinungsfreien Haut (PASI 90) bei 80,2 % unter Guselkumab‑ im Vergleich zu 53 % unter Adalimumab-Therapie.(7) In einem Crossover-Arm der VOYAGE 2-Studie wurden die Patienten, die unter Adalimumab keine 90 %ige Verbesserung des PASI erreichten (n=112), in Woche 28 auf Guselkumab umgestellt. 66,1 % dieser Patienten erzielten unter Guselkumab in Woche 48 eine 90 %ige Verbesserung des PASI.(2)
Stabile Wirksamkeit über zwei Jahre
Es liegen zudem bereits Langzeitdaten aus der Zulassungsstudie VOYAGE 1 vor. Mit Guselkumab konnten die hohen Ansprechraten über einen Zeitraum von zwei Jahren aufrechterhalten werden: Zu jedem Zeitpunkt zwischen den Wochen 24, 52 und 100 haben mehr als 80 % der Patienten ein PASI 90-Ansprechen erreicht (kombinierte Statistik*).(8) In Woche 100 wiesen 94,8 % der Patienten ein PASI 75- und 82,1 % ein PASI 90-Ansprechen unter Guselkumab-Therapie auf. Bei etwa der Hälfte der Patienten (49 %) wurde ein PASI 100 festgestellt.(8)
Gute Verträglichkeit
Guselkumab zeigte in den Zulassungsstudien ein gutes Verträglichkeitsprofil. Die am häufigsten beobachteten unerwünschten Ereignisse waren Nasopharyngitis, Infektionen der oberen Atemwege und Kopfschmerzen. Schwere unerwünschte Ereignisse, wie z.B. schwere Infektionen oder schwere kardiovaskuläre Ereignisse (MACE), traten bei Guselkumab und Adalimumab bis Woche 48 vergleichbar häufig auf.(2, 7) Es gab keine Anzeichen für ein erhöhtes Risiko für Malignome, MACE oder schwere Infektionen einschließlich Tuberkulose und Reaktivierung einer latenten Tuberkulose.(2, 7) Bislang gibt es keine spezifischen Nebenwirkungssignale: Es wurde bisher keine Assoziation zwischen der Gabe von Guselkumab und einem erhöhten Auftreten von Candida-Infektionen, Neutropenien und Morbus Crohn beobachtet.(6) Bis Woche 100 war die Rate schwerwiegender Nebenwirkungen von Guselkumab niedrig und blieb über diesen Zeitraum stabil.(8)
Kooperation zwischen Janssen-Cilag GmbH und Galderma Laboratorium GmbH
Um Ärzte noch umfangreicher zu der neuen Therapieoption beraten sowie über den Fortschritt bei der Behandlung von Patienten mit Plaque-Psoriasis informieren zu können, haben sich die Janssen-Cilag GmbH und die Galderma Laboratorium GmbH entschieden, zu kooperieren. Das gemeinsame Ziel ist es, Patienten über eine lange Zeit eine möglichst erscheinungsfreie Haut zu ermöglichen.
Über Janssen
Als Pharmasparte des Gesundheitskonzerns Johnson & Johnson entwickeln wir im Schulterschluss mit Partnern vor Ort und weltweit innovative Medikamente und ganzheitliche therapiebegleitende Behandlungskonzepte. Schwerpunkte unserer Arbeit sind Onkologie, Immunologie, Psychiatrie und Infektiologie. Damit wollen wir erreichen, was für Patienten wirklich zählt: alltägliche und besondere Momente so zu erleben, wie es vor der Diagnose selbstverständlich war. Weltweit sind über 40.000 Mitarbeiter für Janssen tätig; in Deutschland beschäftigt die Janssen-Cilag GmbH, Neuss, rund 800 Mitarbeiter.
- Mehr Informationen unter: www.janssen.com/Germany
Anmerkung
- * Phase‑III‑Studie, ab Woche 48 Open-Label; die Wirksamkeitsanalyse wurde vordefiniert mittels Non-Responder-Imputation (NRI) bis Woche 48 und mittels Anwendung der Treatment Failure Rules (TFR) von Woche 52 bis Woche 100
Quellen
- Europäische Kommission: Tremfya® (Guselkumab). Verfügbar über: http://ec.europa.eu/health/documents/community-register/html/h1234.htm – Zugriff: November 2017.
- Reich K et al., J Am Acad Dermatol 2017;76(3):418-431
- Mahil S et al., Semin Immunopathol 2016;38(1):11-27
- Girolomoni G et al., J Eur Acad Dermatol Venereol 2017 Jun 27
- Perera GK et al., Annu Rev Pathol 2012;7:385-422
- Aktuelle Fachinformation Tremfya®
- Blauvelt A et al., J Am Acad Dermatol 2017;76(3):405-17
- Griffiths CME et al., VOYAGE 1, D3T01.11, EADV 2017
Abbildungen

Abb. 1: Einfaches Applikationsintervall. Graphik und Copyright: Janssen-Cilag GmbH

Abb. 2: Starke und schnelle Wirksamkeit. Graphik und Copyright: Janssen-Cilag GmbH

Abb. 3: Stabile Wirksamkeit. Graphik und Copyright: Janssen-Cilag GmbH

Abb. 4: Gut verträglich. Graphik und Copyright: Janssen-Cilag GmbH
Quelle: Janssen Cilag, 23.11.2017 (tB).