MEDIZIN
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Neue effektive Therapie bei pulmonal arterieller Hypertonie
Erster oraler Prostacyclin-IP-Rezeptor-Agonist Selexipag (Uptravi®) in Deutschland verfügbar
Freiburg (15. Juni 2016) – Der erste zugelassene orale, selektive Prostacyclin-IP-Rezeptor-Agonist Selexipag (Uptravi®) ist ab jetzt auch in Deutschland zur Langzeittherapie der lebensbedrohlichen pulmonal arteriellen Hypertonie (PAH) erhältlich. Selexipag ist „für die Langzeitbehandlung der PAH bei erwachsenen Patienten der WHO-Funktionsklasse (WHO-FC) II bis III entweder als Kombinationstherapie bei Patienten, deren Erkrankung mit einem Endothelin-Rezeptor-Antagonisten (ERA) und/oder einem Phosphodiesterase-5 (PDE-5)-Inhibitor unzureichend kontrolliert ist oder als Monotherapie bei Patienten, die für diese Therapien nicht infrage kommen“ zugelassen.1 Die therapeutische Nutzung des für die Pathogenese der PAH bedeutenden Prostacyclin-Signalwegs war bislang nicht in Tablettenform möglich. „Dies hat dazu beigetragen, dass diese Therapieschiene deutlich unterrepräsentiert war, besonders in Deutschland. Das oral anwendbare Selexipag verzögert die Progression der PAH signifikant. Mit der neuen oralen Form können jetzt mehr PAH-Patienten von einem therapeutischen Eingriff in diesen Signalweg langfristig profitieren“, erklärte Prof. Dr. med. Ardeschir Ghofrani, Universitätsklinikum Gießen, anlässlich der Pressekonferenz zur Einführung von Uptravi® im Frankfurter Messeturm. „Die aktuellen Leitlinien2 der ESC/ERS (European Society of Cardiology und der European Respiratory Society) empfehlen den Einsatz von Selexipag ab WHO-Funktionsklasse II“, betonte Prof. Dr. med. Stephan Rosenkranz, Cologne Cardiovascular Research Center (CCRC), Universitätsmedizin Köln. Die Zulassung durch die europäische Kommission für Selexipag, das ursprünglich von Nippon Shinyaku entdeckt und synthetisiert wurde, erfolgte am 12. Mai.
„ Dass der Prostacyclinweg hierzulande bislang therapeutisch wenig genutzt wurde, liegt unter anderem an der belastenden subkutanen bzw. intravenösen oder zeitraubenden inhalativen Applikation herkömmlicher Prostacyclin-Analoga und den damit einhergehenden Komplikationen und Einschränkungen der Lebensqualität. Viele Patienten möchten den Beginn einer Prostacyclin 2 therapie auch deshalb so lange wie möglich hinauszögern, weil sie diese als Zeichen für das Fortschreiten ihrer Erkrankung wahrnehmen, erläuterte Ghofrani. Das steht jedoch dem positiven Effekt dieses Therapieansatzes entgegen.
„ Selexipag bietet eine neue, hinsichtlich der Darreichungsform vereinfachte Option für die therapeutische Aktivierung des Prostacyclinwegs bei PAH. Es kann nach den vorliegenden Studiendaten als Add-on-Therapie möglicherweise präventiv eingesetzt werden, um die Erkrankungsprogession zu verzögern “ , so Rosenkranz. Die aktuellen Leitlinien2 der ESC/ERS empfehlen Selexipag mit dem Empfehlungsgrad IB sowohl zur Mono- als auch für die sequentielle Zweifach- bzw. Tripel-Kombinationstherapie mit einem ERA und/oder einem PDE-5-Hemmer in WHO-FC II und III. „ Im Sinne einer bestmöglichen Versorgung der PAH-Patienten auch hierzulande ist dies ein großer Fortschritt “ , ergänzte Hans Dieter Kulla, 1. Vorsitzender der Patientenorganisation ph e.v.
Robuste Studiendaten belegen Wirksamkeit und Sicherheit von Selexipag
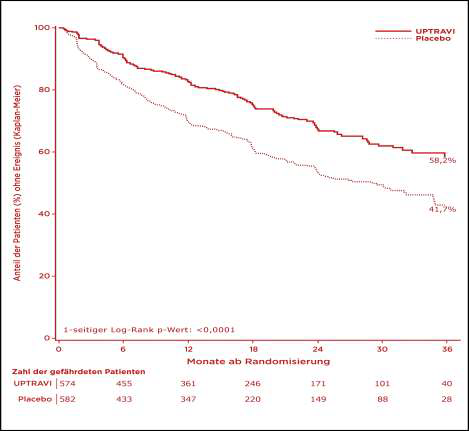
Die Wirksamkeit und die Sicherheit von Selexipag wurde in der zulassungsrelevanten GRIPHON-Studie (Prostacyclin (P G I2) R eceptor agonist I n P ulmonary arterial H ypertensi ON ) nachgewiesen.3 Eingeschlossen wurden Patienten mit idiopathischer und erblicher PAH, PAH in Assoziation mit Bindegewebserkrankungen und PAH in Assoziation mit korrigierten einfachen angeborenen Herzfehlern. Mit 1.156 Patienten war die multizentrische GRIPHON-Studie die größte jemals durchgeführte randomisierte, doppelblinde, placebokontrollierte und ereignisgesteuerte PAH-Langzeitstudie. Die Expositionsdauer betrug maximal 4,2 Jahre und im Mittel 1,4 Jahre.
Dabei erhielten die Patienten zweimal täglich entweder Selexipag s(n=574) oder Placebo (n=582). Bei Studieneintritt waren 20 % der Teilnehmer therapienaiv, 47 % erhielten bereits eine Monotherapie mit einem ERA oder einem PDE-5-Inhibitor und 33 % wurden mit einer Kombination aus einem ERA sowie einem PDE-5-Inhibitor behandelt.3
Signifikant geringere Morbidität/Mortalität * unter Selexipag
Selexipag reduzierte das Morbiditäts-/Mortalitäts-Risiko* signifikant um 40 % (p < 0,0001) gegenüber Placebo (s. Abb.).3 „ Der Behandlungseffekt auf den kombinierten primären Endpunkt erwies sich als konsistent über alle untersuchten Subgruppen hinweg – unabhängig von der Ätiologie und WHO-Funktionsklasse der PAH, vom Alter und Geschlecht der Patienten und auch davon, ob diese bei Studienbeginn bereits mit einem ERA, mit einem PDE-5-Hemmer oder mit beiden Therapeutika behandelt wurden “ , erläuterte Prof. Dr. med. Marius M. Hoeper, Medizinische Hochschule Hannover.
Auch Verbesserung sekundärer Endpunkte
Unter Selexipag stieg die 6-Minuten-Gehstrecke placebokorrigiert im Mittel um 12 Meter bis zur 26. Studienwoche (p = 0,0027). Bei Patienten ohne vorbestehende PAH-spezifische Therapie war ein Anstieg um 34 m zu verzeichnen. Das Risiko eines PAH-assoziierten Todesfalls** oder einer Hospitalisierung aufgrund von PAH wurde unter Selexipag um 30 % gegenüber Placebo reduziert (p = 0,0031).
Bestmögliche Verträglichkeit
„ Als IP-Rezeptor-Agonist gehört Selexipag nicht zu den Prostanoiden. Von diesen unterscheidet es sich strukturell, bindet hochselektiv an den Prostacyclin-IP-Rezeptor und löst vasodilatatorische, antiinflammatorische und antifibrotische Effekte aus. Daher dürften andere, gegensätzlich wirkende Prostanoid-Rezeptoren kaum von Selexipag aktiviert werden “ , so Hoeper. Die häufigsten Nebenwirkungen ( ≥ 3 % über Placebo) von Selexipag waren in der Zulassungsstudie solche, die typischerweise mit der medikamentösen Aktivierung des Prostacyclinwegs einhergehen, wie z. B. Kopfschmerz, Diarrhoe, Schwindel, Myalgie, Kiefer- und Extremitätenschmerz, Arthralgie sowie Flush. Diese waren zumeist leicht bis mittelschwer und traten eher in der Titrationsphase*** auf.1,3 Für eine bestmögliche Anwendbarkeit ist Selexipag in acht verschiedenen Wirkstärken erhältlich, die eine individuell angepasste Dosierung ermöglichen.1
Mit Selexipag besteht erstmals die Option zur oralen Tripel-Kombinationstherapie – dies könnte einen Paradigmenwechsel einläuten.

Abbildung: Eintritt des ersten kombinierten Morbiditäts-Mortalitätsereignisses unter Selexipag im Vergleich zu Placebo1
Über Selexipag1
Selexipag wurde ursprünglich von Nippon Shinyaku entdeckt und synthetisiert und ist ein Prostacyclin-IP-Rezeptor-Agonist. Es gehört nicht zu den Prostanoiden, von denen es sich chemisch und strukturell klar unterscheidet. Selexipag und sein aktiver Metabolit besitzen eine hohe Affinität und Selektivität für den IP-Rezeptor im Vergleich zu anderen Prostanoid-Rezeptoren. Die Stimulation des IP-Rezeptors durch Selexipag und seinen aktiven Metaboliten führt zur Vasodilatation sowie zur Hemmung von Zellproliferation. Selexipag verhindert im Rattenmodell der PAH ein kardiales und pulmonales Remodelling und führt zu einer proportionalen Abnahme des pulmonalen und peripheren Drucks. Wissenschaftliche Daten zeigen, dass Selexipag in vitro im Rattenmodell weder eine Desensibilisierung des IP-Rezeptors noch eine Tachyphylaxie bewirkt.
Zulassungsstatus
Bereits zugelassen ist Selexipag in den USA (21.12.2015), Kanada (21.01.2016), Neuseeland (17.03.2016), Australien (18.03.2016) und Südkorea (11.05.2016). Die Zulassung durch die Europäische Kommission erfolgte am 12.05.2016. Der Zulassungsantrag für die Schweiz wird derzeit behördlich geprüft.
Über den Prostacyclin-Signalweg
Bei bestimmten Erkrankungen ist die Produktion von Prostacyclin durch das Endothel beeinträchtigt, was dazu führt, dass zum Beispiel die schädlichen Effekte von im Übermaß ausgeschüttetem Endothelin oder Thromboxan dominieren. Der Prostacyclin-Signalweg ist einer der drei am besten charakterisierten Signalwege in der Pathophysiologie und Therapie der PAH. Prostacyclin ist ein Prostanoid, das als Signalmolekül im menschlichen Körper fungiert. Wie andere vasoaktive Substanzen wird Prostacyclin von den Endothelzellen produziert. Es wirkt gefäßerweiternd, antiproliferativ, entzündungshemmend und unterbindet die Blutplättchen-Aggregation.
Über PAH
Pulmonal arterielle Hypertonie (PAH) ist eine chronische, lebensbedrohliche Erkrankung, sdie durch einen erhöhten Blutdruck in den Arterien zwischen Herz und Lunge der betroffenen Patienten gekennzeichnet ist. Die Symptome der PAH sind unspezifisch und reichen von leichter Atemnot und Müdigkeit beim Verrichten normaler täglicher Aktivitäten bis hin zu Rechtsherzversagen und schwerwiegender Beeinträchtigung der körperlichen Leistungsfähigkeit und schließlich einer verkürzten Lebensdauer. PAH ist eine Untergruppe der pulmonalen Hypertonie (PH). Zu dieser Untergruppe gehören die idiopathische PAH, die erblich bedingte PAH und PAH infolge Bindegewebserkrankungen, HIV-Infektion und angeborener Herzkrankheit.
In den letzten zehn Jahren wurden bedeutende Fortschritte in Bezug auf das Verständnis der Pathophysiologie der PAH gemacht, die mit der Entwicklung von Behandlungsrichtlinien und neuen Therapien einhergingen. Zu den Arzneimitteln, die auf die drei an die Pathogenese der PAH beteiligten Signalwege ausgerichtet sind, zählen Endothelin-Rezeptor-Antagonisten (ERA), Prostacyclin-Analoga, Prostacyclin-Rezeptor-Agonisten, Phosphodiesterase-5-Inhibitoren und lösliche Guanylatcyclaseinhibitoren. Dank verfügbarer PAH-Therapeutika hat sich die Prognose für PAHPatienten von einer symptomatischen Verbesserung der Belastungstoleranz vor zehn Jahren hin zu einer verzögerten Krankheitsprogression heute verändert. Das verbesserte Verständnis der Krankheit und evidenzbasierte Richtlinien, die anhand der Erkenntnisse aus randomisierten klinischen Studien entwickelt wurden, legen eine frühzeitige therapeutische Intervention, eine zielgerichtete Behandlung und eine Kombinationstherapie nahe.
Über Actelion
Actelion Ltd. ist ein führendes biopharmazeutisches Unternehmen, das Medikamente für bisher unzureichend behandelbare Krankheiten erforscht, entwickelt und vermarktet. Actelion ist wegweisend auf dem Gebiet der pulmonalen arteriellen Hypertonie (PAH). Das PAH-Portfolio deckt das Krankheitsspektrum der WHO-Funktionsklassen II bis IV ab und umfasst Medikamente zur oralen, inhalierbaren und intravenösen Therapie. Actelion verfügt zudem über behördlich zugelassene, jedoch nicht in allen Ländern erhältliche, Therapien für eine Reihe von Krankheiten, die durch Spezialisten behandelt werden. Hierzu zählen Typ-1-Gaucher-Krankheit, Niemann-Pick-Krankheit Typ C, digitale Ulzerationen bei Patienten mit systemischer Sklerose sowie Mycosis fungoides bei Patienten mit kutanem T-Zell-Lymphom.
Das Unternehmen wurde Ende 1997 gegründet und beschäftigt inzwischen über 2.400 engagierte Fachkräfte. Actelion ist in allen wichtigen Märkten der Welt präsent, darunter den Vereinigten Staaten, Japan, China, Russland und Mexiko. Der Hauptsitz des Unternehmens befindet sich in Allschwil / Basel, Schweiz. Die deutsche Niederlassung (Actelion Pharmaceuticals Deutschland GmbH) befindet sich in Freiburg im Breisgau. Actelion Aktien werden an der SIX Swiss Exchange als Titel des Blue-Chip-Index SMI (Swiss Market Index SMI®) gehandelt (Symbol: ATLN). Alle Markennamen sind rechtlich geschützt.
Anmerkungen
- * bei gemeinsamer Betrachtung der beiden primären Endpunktkriterien. Die Senkung der Mortalität war nicht signifikant, wobei die Studie darauf auch nicht ausgelegt war.
- ** Die Senkung der Mortalität war nicht signifikant, wobei die Studie darauf auch nicht ausgelegt war.
- *** Die individuelle Erhaltungsdosis für Selexipag wird durch Titration bestimmt. Die Startdosis liegt bei 200 μ g (2 x tägl.) und wird gesteigert (um jeweils 200 μ g pro Woche), bis sie nicht mehr toleriert wird. Die jeweils nächst niedrigere tolerable Dosis wird dann als Erhaltungsdosis festgelegt. Die Höchstdosis beträgt 1.600 μ g 2 x tgl.
Literatur
- 1 Fachinformation Uptravi®; Stand: Mai 2016
- 2 Galiè N et al. Eur Heart J 2016 Jan 1;37(1):67-119.
- 3 Sitbon O et al. N Engl J Med 2015; 373: 2522-33
Quelle: Actelion, 15. Juni 2016 (tB).