HAUPTMENÜ
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Nuklearmedizin im Wandel:
Advanced Accelerator Applications (AAA) als Vorreiter der Theragnostik
Das Fachgebiet der Nuklearmedizin hat sich in den letzten Jahren so stark verändert wie kaum eine andere medizinische Fachrichtung. Während der klinische Fokus der Nuklearmediziner lange Zeit auf der Diagnostik mittels bildgebender Verfahren lag, haben mit der Etablierung der Radioligandentherapie in den vergangenen Jahren therapeutische Ansätze stark an Bedeutung gewonnen. Einer der Vorreiter in der sogenannten Theragnostik – der Kombination aus zielgerichteter nuklearmedizinischer Therapie und der Diagnostik mit demselben Target – ist das Unternehmen Advanced Accelerator Applications (AAA), eine hundertprozentige NovartisTochter mit Sitz in Bonn.
Bonn (26. November 2020) – Die Nuklearmedizin ist im Wandel. Neben stetig weiter präzisierten diagnostischen Verfahren wie Szintigrafie, Positronen-Emissionstomographie (PET, in Verbindung mit CT und MRT) und Einzelphotonen-Emissionscomputertomographie (SPECT) rückten in den vergangenen Jahren nuklearmedizinische Therapien wie die Peptidrezeptor-Radionuklidtherapie (PRRT) bei Forschern und Anwendern in den Fokus. Zusätzlich gewinnen zugelassene Radiopharmaka an Bedeutung gegenüber der Eigenherstellung in nuklearmedizinisch arbeitenden Kliniken. Dadurch entwickelt sich die Nuklearmedizin nicht nur als eigenständige Disziplin, sondern wird auch zum wichtigen Partner für andere medizinische Fachgebiete wie Gastroenterologie, Endokrinologie und Onkologie.
Advanced Accelerator Applications (AAA), eine hundertprozentige Novartis-Tochter, hat sich als ein Vorreiter in der Entwicklung zugelassener, Evidenz-basierter Theragnostik etabliert. Anlässlich einer virtuellen Fachpressekonferenz inklusive Podiumsdiskussion am 26. November 2020 gaben namhafte Experten Einblicke in und Ausblicke auf die Entwicklungen der Nuklearmedizin in den vergangenen und kommenden Jahren.
PRRT in den Leitlinien
Nuklearmedizinische Verfahren hielten in den vergangenen Jahren vermehrt Einzug in unterschiedliche Behandlungsleitlinien. Mittlerweile sind sie etablierter Bestandteil verschiedener Therapiealgorithmen. Ein Beispiel hierfür sind gastroenteropankreatische neuroendokrine Tumoren (GEP-NET), insbesondere im Dünndarm lokalisiert, aber auch im Pankreas. „Bei Somatostatinrezeptor-positiven Tumoren findet die PRRT ab der Zweitlinie Anwendung“, so Professor Dr. Marianne Pavel vom Universitätsklinikum Erlangen. Dabei gelte es jeweils individuell abzuwägen, welche Patienten zu welchem Zeitpunkt der Behandlung von einer PRRT profitieren. Bei Dünndarm-NET ist die PRRT laut Pavel bereits jetzt die häufigste Option der Zweitlinientherapie.
NETTER-1-Studie als Meilenstein für die PRRT bei GEP-NET
Professor Dr. Markus Essler vom Universitätsklinikum Bonn stellte im Rahmen der Presseveranstaltung die Meilenstein-Studie NETTER-1 vor. Dabei handelt es sich um die erste Phase-III-Studie zu Wirksamkeit und Sicherheit von 177Lu-Dotatate bei Patienten mit gut differenzierten (G1 und G2) GEPNET.1 Die Patienten zeigten ein signifikant verlängertes Progressionsfreies Überleben (PFS) unter einer 177Lu-Dotatate-Therapie im Vergleich zu einer Behandlung mit Somatostatin-Analoga (SSA)*: Das Risiko für einen Krankheitsfortschritt wurde um 79 % verringert.1 Bei der NETTER-1 Studie handelt es sich um die Zulassungsstudie des 177Lu-Dotatate-Therapeutikums Lutathera®.2,3
Im weiteren Verlauf betonte Professor Essler die Bedeutung von zugelassenen Therapien in der Nuklearmedizin. Diese könnten helfen, die Nuklearmedizin weiterzuentwickeln und diese Disziplin zunehmend in der Onkologie zu etablieren. Derzeit liege der Fokus auf der PRRT bei neuroendokrinen Tumoren, aber weitere Indikationen, zum Beispiel das Prostata-Karzinom, werden in den nächsten Jahren folgen.
AAA setzt auf Theragnostik
Dr. Dirk Holler, General Manager Germany & Austria von AAA, betonte bei der Veranstaltung, dass AAA auf die Entwicklung Evidenz-basierter und zugelassener Theragnostika setze, um möglichst vielen Patienten innovative Diagnose- und Behandlungsmöglichkeiten zur Verfügung zu stellen. So bietet das Unternehmen mit SomaKit TOC™4, einem Kit zur Synthese einer 68Ga-Edotreotidlösung für die PET, und dem PRRT-Arzneimittel Lutathera5 (177Lu-Dotatate) als erster Hersteller zugelassene Radiopharmaka sowohl für die Diagnostik als auch zur Therapie in einer Indikation an. Beide Radiopharmaka sind zugelassen zur Diagnose beziehungsweise Behandlung von gut differenzierten (G1 oder G2) Somatostatinrezeptor-positiven GEP-NET.2,3,6,7 In der Entwicklungs-Pipeline des Unternehmens befinden sich zudem weitere theragnostische Ansätze für andere Indikationen – beispielsweise zum ProstataKarzinom.
Anmerkung
* Lutathera-Arm (n = 116): 4 Dosen mit 7,4 GBq (200 mCi) Lutathera alle 8 Wochen + 30 mg Octreotid alle 4 Wochen; Kontroll-Arm (n = 113): 60 mg SSA alle 4 Wochen. Geschätztes progressionsfreies Überleben (estimated PFS) nach 20 Monaten: 65,2 % (95 % KI: 50,0–76,8) unter Lutathera vs. 10,8 % (95 % KI: 3,5–23) in der Kontrollgruppe.
Abbildungen
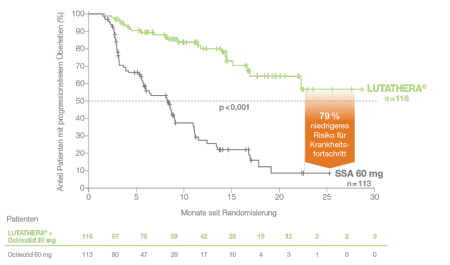
Abb. 1: : Die Therapie mit Lutathera verlängert das progressionsfreie Überleben signifikant.
Modifiziert nach Strosberg J et al. 20171
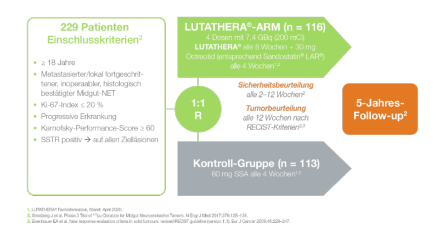
Abb. 2: Das Studiendesign der Meilensteinstudie NETTER-1 im Überblick1
Quelle: 1. Strosberg J et al. Phase 3 Trial of 177Lu-Dotatate for Midgut Neuroendocrine Tumors. N Engl J Med 2017;376:125–135.
Über Advanced Accelerator Applications S.A. (AAA)
AAA ist ein führender Anbieter von Diagnostikverfahren und Radioligandentherapien. Die NovartisTochter beschäftigt weltweit über 1000 Mitarbeiter an 31 Standorten in 12 Ländern. In Deutschland ist die Advanced Accelerator Applications GmbH in Bonn und München vertreten. Das hochspezialisierte Unternehmen entwickelt zielgerichtete, Evidenz-basierte Diagnostikverfahren und Radioligandentherapien und ist ein führender Anbieter in der Nuklearmedizin.
AAA vereint innovative Ansätze mit 20 Jahren Erfahrung in der Nuklearmedizin und über 15 Jahren Erfahrung in der Herstellung von nuklearmedizinischen Diagnostika für die Bildgebung. Als TheragnostikPionier möchte AAA den Zugang zu innovativen, zielgerichteten Diagnose- und Therapielösungen ermöglichen, um Leben zu verlängern und Lebensqualität zu verbessern.
- Weitere Informationen finden Sie im Internet unter www.adacap.com
Über SomaKit TOC™4
SomaKit TOC ist ein Diagnostikum zur Lokalisierung von Primärtumoren und Metastasen bei erwachsenen Patienten mit bestätigten oder Verdacht auf gut differenzierte gastroenteropankreatische neuroendokrine Tumoren (GEP-NET). Hierzu wird eine aus den Bestandteilen des SomaKit TOC-Kits hergestellte Infusionslösung mit 68Ga radioaktiv markiert. Die erhaltene 68Ga-Edotreotidlösung ist angezeigt zur Bildgebung per Positronenemissionstomographie (PET) von überexprimierten Somatostatinrezeptoren.
Über LUTATHERA®5
Lutathera (177Lu-Oxodotreotid) ist ein mit 177Lu markiertes Somatostatin-Analog-Peptid und gehört zu einer Gruppe von Arzneimitteln, die bei Behandlungen eingesetzt werden, die als PeptidrezeptorRadionuklid-Therapie (PRRT) bezeichnet werden. Luthathera trägt eine radioaktive Komponente und bindet an maligne Zellen, die Subtyp-2-Somatostatinrezeptoren überexprimieren. Das enthaltene 177Lu ist ein β-Strahlen emittierendes Radionuklid, das Zieltumorzellen abtötet und gleichzeitig lediglich begrenzt auf benachbarte normale Zellen wirkt. Lutathera® 370 MBq/ml Infusionslösung ist in der EU zugelassen zur Behandlung von nicht resezierbaren oder metastatischen, progressiven, gut differenzierten (G1 und G2) Somatostatinrezeptor-positiven gastroenteropankreatischen neuroendokrinen Tumoren (GEP-NET) bei Erwachsenen.
Sicherheitshinweis: Radioaktive Arzneimittel dürfen nur von dazu berechtigten Personen in speziell dafür bestimmten klinischen Bereichen in Empfang genommen, gehandhabt und verabreicht werden und unterliegen den Bestimmungen der zuständigen Aufsichtsbehörde und / oder entsprechenden Genehmigungen. Radioaktive Arzneimittel dürfen nur unter Vorkehrungen zum Schutz vor ionisierenden Strahlen und unter Beachtung pharmazeutischer Qualitätsanforderungen zubereitet werden. Entsprechende aseptische Vorsichtsmaßnahmen müssen getroffen werden.
Quellen
- Strosberg J et al. Phase 3 Trial of 177Lu-Dotatate for Midgut Neuroendocrine Tumors. N Engl J Med 2017;376:125–135.
- Zulassung der U.S. Food and Drug Administration vom 26.01.2018.
- Zulassung der European Medicines Agency vom 26.09.2017.
- Aktuelle Fachinformation SomaKit TOC™; Stand: März 2020.
- Aktuelle Fachinformation LUTATHERA®; Stand: April 2020.
- Zulassung der European Medicines Agency vom 08.12.2016.
- Zulassung der U.S. Food and Drug Administration vom 01.06.2016 (Netspot®).
Quelle: Advanced Accelerator Applications S.A. (AAA), 26.11.2020 (tB).
Schlagwörter: Nuklearmedizin, Theragnostik


