MEDIZIN
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Pazopanib: Ausschuss der EMA befürwortet Zulassung
- Neue Entwicklung für Patienten mit Nierenzellkarzinom
- Pazopanib kann progressionsfreie Überlebenszeit mehr als verdoppeln
Berlin (25. Februar 2010) – Am 18. Februar 2010 erteilte das Committee for Medicinal Products for Human Use (CHMP) ein positives Votum für die Zulassung unter Auflagen für den oralen Multi-Target-Tyrosinkinase-Inhibitor Pazopanib. Pazopanib soll zur First-Line-Therapie des fortgeschrittenen Nierenzellkarzinoms indiziert sein sowie für Patienten, die bereits eine Zytokintherapie erhalten hatten. Die Substanz hat sich in einer großen Phase-III-Studie bei Patienten mit lokal fortgeschrittenem und/oder metastasiertem Nierenzellkarzinom als erfolgreich erwiesen: Der vom Unternehmen GlaxoSmithKline (GSK) entwickelte Wirkstoff konnte die progressionsfreie Überlebenszeit mehr als verdoppeln im Vergleich zu Placebo.2,3
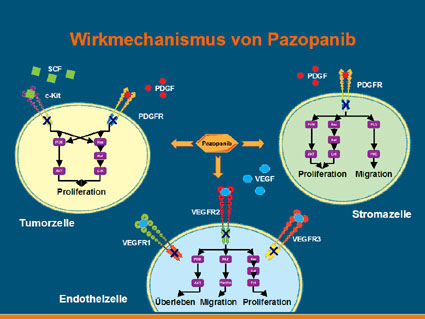
Pazopanib zählt zu den Tyrosinkinase-Inhibitoren der zweiten Generation und wirkt vor allem über eine Blockade der Gefäß-Wachstumsfaktoren (VEGFR 1, 2 und 3) sowie der Plättchen-Wachstumsfaktoren alpha und beta. Die Substanz verhindert damit die Ausbildung und Vermehrung von Tumorblutgefäßen (Antiangiogenese), was letztendlich zum Absterben des Tumors führt.
„Die medikamentöse Behandlung des fortgeschrittenen und metastasierten Nierenzellkarzinoms hat in den letzten Jahren eine Revolution erlebt“, meint PD Dr. Hartmut Kirchner, internistischer Onkologe und Chefarzt der Medizinischen Klinik III für Hämatologie und Onkologie am KRH Klinikum Siloah, Hannover. „Das Patientenkollektiv dieser Studie ist typisch für das fortgeschrittene Nierenzellkarzinom. Wir sind also zuversichtlich, dass sich die vorgestellten Ergebnisse auch im Klinikalltag bestätigen lassen, sobald das Präparat zugelassen ist.“
Umfassende Phase-III-Studiendaten 2
Die 435 in die internationale, randomisierte, doppelblinde Phase-III-Studie (VEG 105192) eingeschlossenen Patienten waren entweder nicht oder nur mit einer Zytokin-basierten Therapie medikamentös vorbehandelt (jeweils ca. 50 %). Nach Randomisierung im Verhältnis 2:1 erhielten die Patienten entweder Pazopanib (800 mg/Tag oral; n = 290) oder Placebo (n = 145). Patienten unter Placebo konnten bei Tumorprogression in die Pazopanib-Gruppe wechseln (Crossover). Primärer Studienendpunkt war die progressionsfreie Überlebenszeit, sekundäre Endpunkte umfassten die Gesamtüberlebenszeit, die Gesamtansprechrate, Sicherheit der Behandlung und Lebensqualität der Patienten.
Vorteile unter Pazopanib für alle Behandlungsgruppen 2
Die Ergebnisse zeigten in der mit Pazopanib behandelten Gruppe eine mediane progressionsfreie Überlebenszeit von 9,2 Monaten im Vergleich zu 4,2 Monaten in der Placebogruppe, ein signifikanter Unterschied (p < 0,0001). Wurden nur die Daten von nicht-vorbehandelten Patienten ausgewertet, zeigte sich eine mediane progressionsfreie Überlebenszeit von 11,1 Monaten für Pazopanib (2,8 Monate für Placebo, p < 0,0001). Bei mit Zytokinen vorbehandelten Patienten ergab sich eine mediane progressionsfreie Überlebenszeit von 7,4 Monaten unter Pazopanib (4,2 Monate unter Placebo).
Für die sekundären Endpunkte zeigte sich in der Pazopanib-Gruppe eine Gesamtansprechrate von 30 % (3 % im Placebo-Arm), mit einer medianen Ansprechdauer von 59 Wochen. Der Vorteil von Pazopanib war dabei unabhängig von Allgemeinzustand, Alter, Geschlecht und Risikoprofil nach Motzer.* Die mediane Gesamtüberlebenszeit lag bei 21,1 Monaten (Pazopanib) bzw. 18,7 Monaten (Placebo) – ein Trend zugunsten von Pazopanib trotz einer hohen Crossover-Rate von 48 % und einer noch relativ kurzen Nachbeobachtungszeit.
Positives Nutzen-Risiko-Profil 2
Insgesamt erwies sich Pazopanib als gut verträglich, die meisten unerwünschten Ereignisse waren leicht bis mäßig ausgeprägt (WHO-Schweregrade 1 bis 2). Am häufigsten (bei ≥ 20 % der Patienten) fanden sich Durchfälle, Blutdruckerhöhungen, farbliche Veränderungen der Haare, Übelkeit, Anorexie und Erbrechen. Die häufigste Laborwertabweichung (bei ≥ 50 % der Patienten) war eine Erhöhung der Leberenzymwerte. Einige der Klasseneffekte für anti-angiogenetisch wirkende Tyrosinkinase-Hemmer traten in der Studie mit einer Inzidenz von weniger als 10% auf. So entwickelten unter Pazopanib 9 % der Patienten eine Proteinurie, 6 % ein Hand-Fuß-Syndrom, 7 % eine Schilddrüsenunterfunktion und jeweils 4 % eine Mukositis bzw. Stomatitis. Das sei, so betonte Kirchner, seltener als mit dieser Substanzklasse erwartet.
Hämatologische Nebenwirkungen (Unterdrückung der Blutzellproduktion im Knochenmark) waren unter Pazopanib ebenfalls vergleichsweise gering ausgeprägt und im Allgemeinen vom Schweregrad 1 oder 2, bei weniger als 5 % der Patienten vom Schweregrad 3 oder höher.
Lebensqualität bleibt erhalten
Für die Beurteilung der Lebensqualität wurden drei validierte, gesundheitsbezogene Fragebögen ausgewertet. Die Ergebnisse ergaben zu keinem Zeitpunkt der Therapie einen klinisch relevanten Unterschied zwischen Pazopanib und Placebo – ein wichtiger Faktor bei fortgeschrittenen Erkrankungsstadien, in denen eine Heilung nicht mehr zu erwarten ist. „Pazopanib verlängert anscheinend die progressionsfreie Überlebenszeit, ohne die Lebensqualität wesentlich einzuschränken“, so Kirchner.
Extensionsstudie bestätigt die Daten 4
Die Patienten im Placebo-Arm, die wegen einer Tumorprogression auf eine Behandlung mit Pazopanib wechselten, wurden im Rahmen einer Extensionsstudie noch einmal separat bezüglich Wirksamkeit und Verträglichkeit der Pazopanib-Gabe ausgewertet (71 Patienten); davon waren 34 (48 %) nicht mit Zytokinen vorbehandelt. Die mediane Dauer der Pazopanib-Behandlung war 5,7 Monate. Die Ergebnisse der Extensionsstudie bestätigen die Wirksamkeits- und Verträglichkeitsdaten der Hauptstudie. Die Ansprechrate betrug 32,4 % (23 von 71 Patienten). Die progressionsfreie Überlebenszeit betrug im Median 8,3 Monate. Unerwünschte Ereignisse waren meist mild bis mäßig ausgeprägt.
Direkte Vergleichsstudie läuft
Schon seit 2008 läuft weltweit die direkte Vergleichsstudie COMPARZ (COMParing the efficacy, sAfety and toleRability of paZopanib vs sunitinib in first line advanced and/or metastatic renal cell carcinoma), die bei nicht-vorbehandelten Patienten mit fortgeschrittenem und/oder metastasiertem Nierenzellkarzinom direkt die beiden Substanzen Pazopanib und Sunitinib (derzeit der Therapiestandard für die Primärbehandlung) vergleicht. Dabei soll die Nicht-Unterlegenheit von Pazopanib gegenüber dem Multikinase-Inhibitor Sunitinib gezeigt werden. Möglicherweise, so Kirchner, zeigen sich dabei Unterschiede der beiden Substanzen im Profil der unerwünschten Wirkungen. Das CHMP knüpfte die Zulassungsempfehlung an die Auflage, dass nach Markteinführung Daten aus der abgeschlossenen Studie vorgelegt werden. Insgesamt wurden in Deutschland bereits mehr als 40 Patienten in die Studie aufgenommen.
Weitere Informationen dazu finden sich unter www.clinicaltrials.gov
Anmerkung
[1] Score aus den fünf Parametern Performance-Status <80%, LDH > 1,5fach, Hämoglobin < 10g/dl, Serumcalcium > 10mg/dl und Metastasen-Entstehung innerhalb eines Jahres nach Motzer RJ et al.
Abbildungen

Abb. 1: Wirkmechanismus von Pazopanib. Photo: GlaxoSmithKline

Abb. 2: Tumorangiogenese. Photo: GlaxoSmithKline

Abb. 3: Tumorangiogenese. Photo: GlaxoSmithKline

Abb. 4: Tumorangiogenese. Photo: GlaxoSmithKline
Download
Factsheet Nierenzellkarzinom: ![]() Factsheet_Nierenzellkarzinom_DKK-2010_FINAL.pdf (95.12 KB)
Factsheet_Nierenzellkarzinom_DKK-2010_FINAL.pdf (95.12 KB)
Factsheet Pazopanib: ![]() Factsheet_Pazopanib_DKK-2010_FINAL.pdf (81.48 KB)
Factsheet_Pazopanib_DKK-2010_FINAL.pdf (81.48 KB)
Referenzen
- http://www.ema.europa.eu/pdfs/human/opinion/Votrient_10490510en.pdf und http://www.ema.europa.eu/pdfs/human/press/pr/9510610en.pdf
- Sternberg C et al. Pazopanib in Locally Advanced or Metastatic Renal Cell Carcinoma: Results of a Randomized, Phase III Trial. JCO 2010 Published Ahead of Print on January 25, 2010 as 10.1200/JCO.2009.23.9764
- http://www.clinicaltrial.gov/ct2/show/NCT00334282?term=VEG+105192&rank=2 (letzter Zugriff 18.01.2010)
- Hawkins RE, Hong SJ, Ulys A et al. Extension Study to VEG105192 to Assess Pazopanib in Patients With Advanced/Metastatic Renal Cell Cancer. J Clin Oncol 2009; 27: Suppl.; Abstract 5110
Über GlaxoSmithKline
GlaxoSmithKline – eines der weltweit führenden forschenden Arzneimittel- und Healthcare-Unternehmen – engagiert sich für die Verbesserung der Lebensqualität, um Menschen ein aktiveres, längeres und gesünderes Leben zu ermöglichen.
Quelle: Pressekonferenz der Firma GlaxoSmithKline (GSK) im Rahmen des 29. Deutschen Krebskongresses (24.-27. Februar 2010) zum Thema “Herausforderungen in der Hämatologie und Onkologie – innovative Produkte von GSK” am 25.02.2010 in Berlin (tB).