HAUPTMENÜ
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Prionen-Faltung an der Zellmembran untersucht
Erstmalige Beobachtung der ersten Schritte der Fehlfaltung
Bochum (4. August 2008) – Auslöser von Erkrankungen wie der Creutzfeldt-Jacob-Krankheit, Rinderwahn (BSE) und Alzheimer sind fehlgefaltete Proteine. Unklar ist bis heute, warum sie fehlfalten. Ausschlaggebend für die Krankheitsentstehung scheinen die ersten Schritte der Faltung und der Beginn der Aggregation von Proteinen, die so genannte Oligomerisierung, zu sein. Diese Schritte konnten Bochumer und Düsseldorfer Forscher um Prof. Dr. Klaus Gerwert und Prof. Dr. Detlev Riesner jetzt erstmals in der natürlichen Umgebung des Proteins beobachten. Sie untersuchten die Faltung des Prion-Proteins, des Auslösers der Creutzfeldt-Jakob Krankheit, indem sie es mit natürlichem Anker an eine Zellmembran banden. "Überraschenderweise verhält sich so verankertes Prion-Protein anders als in Lösung", fasst Prof. Gerwert zusammen. "Unstrukturierte Teile des Proteins werden so gefaltet, dass sich ein anderes Prion-Protein leicht anlagern kann – der mögliche Beginn der krankheitsauslösenden Strukturierung." Über die Ergebnisse der Forscher berichtet die aktuelle Online-Ausgabe der Proceedings der National Academie of Science (PNAS).

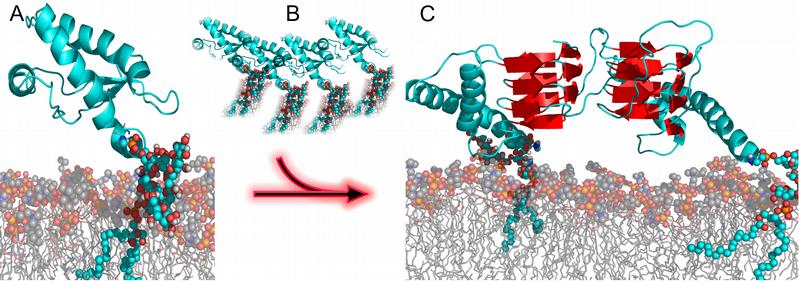
Abb. 1: An fehlgefaltete Prion-Proteine lagern sich weitere an und nehmen ebenfalls die falsche Faltung ein. Es entstehen Ablagerungen, die zum Absterben von Zellen führen.
Falsche Faltung in Kopie
Das Prion-Protein liegt im gesunden Organismus in physiologischer, wohlgefalteter Form vor, besonders im Zentralnervensystem. Wenn sich Prion-Proteine umfalten, können sie sich in fehlgefaltete, infektiöse Prion-Proteine verwandeln. Nach und nach bilden sich so unlösliche Ablagerungen in den Zellen, so genannte Amyloidstrukturen, die letztlich zum Absterben der befallenen Zellen führen. Amyloiderkrankungen enden immer tödlich.
Membranbindung ändert das Verhalten der Prionen
Gerwert und Riesner konnten erstmals die Situation in der lebenden Zelle nachstellen, indem sie das Prion-Protein mit seinem eigenen Membrananker an der Zellmembran gebunden untersuchten. Dabei fanden sie zu ihrer großen Überraschung, dass das membranverankerte Protein sich an der Membran anders verhält als nicht-verankertes in Lösung, was in bisherigen biophysikalischen Arbeiten im Mittelpunkt stand. Auch die Bestimmung der dreidimensionalen Raumstruktur des Prion-Proteins durch Nobelpreisträger Kurt Wüthrich wurde an ankerlosen Prion-Proteinen durchgeführt. "Bei hoher Prion-Protein-Konzentrationen an der Membran werden nicht strukturierte Teile des Prion-Proteins so umgefaltet, dass sich leicht mehrere Prion-Proteine anlagern können", beschreibt Prof. Gerwert seine Beobachtungen. "Es bilden sich so genannte Beta-Faltblätter aus, an der sich die Proteine leicht passgenau anlagern können, ähnlich zweier Wellblechplatten." Die Umfaltung scheint also die Oligomerisierung und vielleicht auch die krankmachende Struktur zu induzieren. Eine Struktur des voll glykosylierten Prion-Proteins an der Membran wurde in bisherigen Arbeiten noch nicht beschrieben.
Infrarotspektroskopie bildet die Faltung ab
Ermöglicht wurde die neue Erkenntnis durch die interdisziplinäre Zusammenarbeit der beiden Arbeitsgruppen. Das Düsseldorfer Team hat bereits in der Vergangenheit wichtige Beiträge auf dem Gebiet der Prion-Forschung erbracht. Die Umfaltungsstudien an den Membranen wurden dann in Bochum durchgeführt. Dabei kam eine neue Methode zum Einsatz: das Prion-Protein wurde an einer Membran verankert, die auf einem so genannten ATR-Kristall aufgetragen war. Die Faltung des Proteins wurde dann mit Infrarot-Spektroskopie analysiert. "Führt man einen Infrarotstrahl durch den ATR-Kristall, dann dringt ein Teil der Strahlung in die an der Oberfläche angelagerte Probe ein und wird absorbiert", erläutert Prof. Gerwert. "Die Absorption ist dabei genauso für die jeweilige Proteinstruktur charakteristisch wie ein Fingerabdruck für einen Menschen charakteristisch ist." Jede Proteinstruktur erzeugt im Infrarotspektrum ein individuelles Muster. Dessen Veränderung zeigt direkt einen Umfaltungsprozess .
RUB-Absolvent arbeitet mit Nobelpreisträger zusammen
Julian Ollesch, der im Rahmen seiner Doktorarbeit im Labor von Professor Gerwert die Infrarot-Messungen durchgeführt hat, ist jetzt als Postdoc ins Labor von Stanley Prusiner gewechselt. Prusiner wurde 1997 mit dem Nobelpreis geehrt, weil er als erster erkannt hatte, dass die Prionenerkrankungen durch fehlgefaltete Proteine ausgelöst wird. Bis zu Pruisiners Entdeckung war unbekannt, dass fehlgefaltete Proteine direkt Krankheiten auslösen können. Damit hat er das Forschungsgebiet der Amyloiderkrankungen begründet.
Titelaufnahme
Kerstin Elfrink, Julian Ollesch, Jan Stöhr, Dieter Willbold, Detlev Riesner and Klaus Gerwert: Structural changes of membrane-anchored native PrP C. In: PNAS published July 31, 2008, doi:10.1073/pnas.0804721105
Quelle: Pressemitteilung der Ruhr-Universität Bochum vom 04.08.2008.
Abb. 1: An fehlgefaltete Prion-Proteine lagern sich weitere an und nehmen ebenfalls die falsche Faltung ein. Es entstehen Ablagerungen, die zum Absterben von Zellen führen.