PHARMAKOLOGIE
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Residuale Exzessive Tagesschläfrigkeit (rEDS) bei Obstruktiver Schlafapnoe und Narkolepsie behandeln:
Sunosi® (Solriamfetol) als neue Therapieoption
München (19. November 2020) – „Es gibt Patienten mit einer obstruktiven Schlafapnoe, die trotz adäquater Primärtherapie weiterhin an einer Exzessiven Tagesschläfrigkeit (Excessive Daytime Sleepiness, EDS) leiden. In diesen Fällen sprechen wir von residualer Exzessiver Tagesschläfrigkeit (rEDS)“, erklärte Prof. Dr. rer. physiol. Thomas Penzel, Charité, Berlin, bei einem Symposium von Jazz Pharmaceuticals im Rahmen des virtuellen Kongresses der Deutschen Gesellschaft für Schlafforschung und Schlafmedizin (DGSM).
Bisher gab es für die Therapie der rEDS bei einer OSA keine zugelassenen medikamentösen Optionen und für die Therapie der EDS bei der Narkolepsie nur begrenzte Möglichkeiten. Seit Mai 2020 ist mit Sunosi® (Solriamfetol) ein neues Medikament zur signifikanten Verbesserung der Wachheit und Reduzierung der Exzessiven Tagesschläfrigkeit (Excessive Daytime Sleepiness, EDS) bei Erwachsenen mit Narkolepsie (mit oder ohne Kataplexie) oder obstruktiver Schlafapnoe (Obstructive Sleep Apnea, OSA) verfügbar. Voraussetzung für die Therapie mit Sunosi® bei einer OSA ist, dass die EDS durch die primäre Therapie der OSA, beispielsweise durch kontinuierlichen positiven Atemwegsdruck (Continuous Positive Airway Pressure, CPAP), nicht ausreichend behandelt werden konnte.
„Die Prävalenz der residualen Exzessiven Tagesschläfrigkeit (rEDS) liegt bei Patienten mit OSA, deren primäre Ursache behandelt wurde, bei 13 %“, so Prof. Penzel.1 Zwar könne man diese Zahl teilweise durch Compliance-Probleme erklären, aber es gäbe Patienten, die trotz richtiger Anwendung des kontinuierlichen positiven Atemwegsdrucks (Continuous Positive Airway Pressure, CPAP) weiterhin von einer starken Einschlafneigung berichten. Wichtig sei es daher, auch Komorbiditäten auszuschließen. „Wenn ein Patient mit OSA trotz gleichzeitiger Primärtherapie von einem gestörten bzw. nicht erholsamen Schlaf berichtet und er für mehr als 3 Monate tagsüber ungewollte Schlafperioden erlebt, dann gilt es verschiedene EDS-assoziierte Erkrankungen differenzialdiagnostisch auszuschließen“, erklärte Penzel. Mögliche EDS-assoziierte Erkrankungen seien beispielsweise schlafbezogene Atmungsstörungen, Syndrom der ruhelosen Beine (Restless-Legs-Syndrom, RLS), Idiopathische Hypersomnie, Kleine-Levin-Syndrom und Narkolepsie.2,3 EDS kann zu einer negativen Gefühlslage, verminderter Gedächtnisleistung und Konzentrationsschwierigkeiten führen. Sie kann Beziehungen belasten und die Arbeitsleistung reduzieren. Meist wird eine allgemeine Verringerung der Lebensqualität beobachtet.4,5,6,7,8
Narkolepsie: Herausforderung Diagnose
Die Exzessive Tagesschläfrigkeit ist bei Patienten mit Narkolepsie eines der Hauptsymptome. Die Diagnose der seltenen Erkrankung ist dabei nicht immer einfach. „Bis zur richtigen Diagnose einer Narkolepsie dauert es durchschnittlich 10 Jahre und Patienten besuchen bis zu drei verschiedene Schlaflabore“, so Dr. med. Anna Heidbreder, Medizinische Universität Innsbruck. Das läge unter anderem daran, dass die Narkolepsie mit einer geschätzten Prävalenz von 0,02 % in Europa sehr selten ist.9 „Meine Patienten berichten häufig, dass die behandelnden Ärzte eher durch Zufälle auf die richtige Diagnose gestoßen sind.“ Es gibt fünf Kernsymptome der Narkolepsie: EDS, Kataplexie, schlafbezogene Halluzinationen, Schlaflähmung und Schlafstörungen.10 Die Diagnostik solle laut Heidbreder immer mit einer ausführlichen Anamnese beginnen. Im Anschluss könne eine Aktigraphie sowie Polysomnographie mit multiplem Schlaflatenztest (Multiple Sleep Latency Test, MSLT) bei der Diagnosestellung unterstützen.
EDS: Dem gemeinsamen Nenner auf die Spur kommen
Laut Penzel sei es nicht immer einfach, die Diagnose „EDS“ zu stellen, da nur limitierte diagnostische Mittel zur Verfügung stünden. Möglich sei eine objektive Erfassung der Schläfrigkeit mittels Multiplem Schlaflatenztest. Dieser Test misst in einem abgedunkelten Raum unter anderem mittels EEG die mittlere Einschlafdauer. Er besteht aus 4 bis 6 Intervallen, mit einer Dauer von je 20 Minuten. Wenn die mittlere Einschlaflatenz im MSLT unter 8 Minuten liegt, weist dies auf eine erhöhte Einschlafbereitschaft hin. Zudem kann die Fähigkeit, für eine definierte Zeit wach zu bleiben, polysomnographisch im Schlaflabor mit dem sogenannten Multiplen Wachbleibetest (Maintenance of Wakefulness Test, MWT) getestet werden. Ein MWT mit einer mittleren Einschlaflatenz unter 8 Minuten deutet auf eine EDS hin.11,12 Eine subjektive Erfassung ist mittels Epworth-Schläfrigkeitsskala (ESS) möglich. Dieser Fragebogen erfragt retrospektiv die Wahrscheinlichkeit für das Einschlafen in acht typischen Alltagssituationen. Bei einem ESS-Score von ≥ 10 spricht man von EDS.11,13
Narkolepsie und Obstruktive Schlafapnoe: Neue Therapieoption bei EDS
Seit Mai 2020 steht mit dem dualen Dopamin- und Noradrenalin-Wiederaufnahmehemmer (Dopamine and Norepinephrine-reuptake Inhibitor, DNRI) Sunosi® (Solriamfetol) eine neue medikamentöse Therapieoption zur Behandlung von EDS bei Erwachsenen mit Narkolepsie oder OSA zur Verfügung. Sunosi® ist in den Dosierungen 75 mg und 150 mg zur Verbesserung der Wachheit und zur Verringerung der EDS bei Narkolepsie sowie in den Stärken 37,5 mg, 75 mg und 150 mg bei OSA zur Verringerung der rEDS zugelassen. Es stellt keinen Ersatz für eine primäre OSA-Therapie dar, sondern ist indiziert für Patienten, bei denen die EDS durch die Primärtherapie nicht zufriedenstellend behandelt werden konnte. Die OSA-Primärtherapie ist trotz Behandlung der EDS beizubehalten. Die Zulassung von Sunosi® basiert auf vier randomisierten, doppelblinden Placebo-kontrollierten Studien im Rahmen des Studienprogramms TONES (Treatment of Obstructive Sleep Apnea and Narcolepsy Excessive Sleepiness).14,15
Sunosi®: Signifikante Verbesserungen der mittleren MWT, ESS und PGIc
Laut Heidbreder verlängerte sich bei Patienten mit Narkolepsie die mittlere MWTSchlaflatenz bereits ab der 1. Woche signifikant und über den gesamten Studienzeitraum von 12 Wochen in der Dosierung von 150 mg im Vergleich zu Placebo (siehe Abbildung 1). Auch der ESS zeigte über 12 Wochen in allen Dosierungen eine signifikante Reduzierung der EDS im Vergleich zur Placebo-Gruppe.16 Positiv sei auch die beobachtete signifikante Verbesserung des klinischen Gesamtzustandes (Patient Global Impression of Change, PGIc) der Probanden. Dieser zeigte sich in der Dosierung von 75 mg Sunosi® bei etwa 68 % der Narkolepsie-Patienten und in der Dosierung von 150 mg bei rund 78 %.17

Abbildung 1: Im Rahmen der Zulassungsstudie TONES 2, zeigte Solriamfetol im Vergleich zu Placebo Verbesserungen im MWT, ESS und PGIc. Modifiziert nach 16.
Prof. Dr. med. Georg Nilius, Evangelische Kliniken Essen-Mitte, bestätigte die positiven Eigenschaften von Sunosi® in Bezug auf die Behandlung der rEDS als Folge der OSA: „Im Rahmen der Zulassungsstudien sahen wir auch hier signifikante Verbesserungen des MWT und der ESS sowie des PGIc im Vergleich zur Placebogruppe.“ Nilius ergänzt: „Neben der Verbesserung der Lebensqualität, zielt die Therapie der rEDS auch auf die Reduktion von Unfallraten und Folgeerkrankungen ab.“ Sunosi® zeigte sowohl bei adäquater als auch bei inadäquater Anwendung der CPAP-Therapie eine statistisch signifikant verbesserte Wachheit bei Patienten mit OSA. Es verbesserte die Wachheit bereits 1 Stunde nach Einnahme signifikant und die Wirkung kann bis zu 9 Stunden lang anhalten (s. Abbildung 2).17,18,19
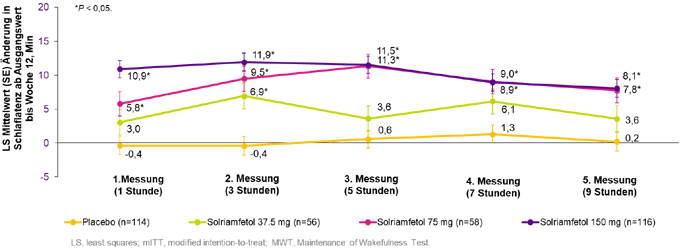
Abbildung 2: Multipler Wachbleibetest (MWT) bei der Therapie mit Sunosi® in den Dosierungen 37,5 mg, 75 mg und 150 mg zur Behandlung der EDS bei Erwachsenen mit OSA. Modifiziert nach 17.
Die Tablette sollte morgens nach dem Aufwachen eingenommen werden. Dabei sei es laut Nilius irrelevant, ob die Tablette vor, während oder nach einer Mahlzeit eingenommen werde.14
Die häufigsten Nebenwirkungen waren Kopfschmerzen (11,1 %), Übelkeit (6,6 %) und verminderter Appetit (6,8 %). Der überwiegende Teil der am häufigsten berichteten Nebenwirkungen trat innerhalb der ersten zwei Wochen der Behandlung auf und verschwand bei den meisten Patienten innerhalb von zwei Wochen. Sunosi® unterliegt nicht dem Betäubungsmittelgesetz (BtMG).14
Eine vollständige Liste der Nebenwirkungen sowie Informationen über Dosierung, Art der Anwendung, Kontraindikationen und andere Vorsichtsmaßnahmen bei der Anwendung von Sunosi® finden Sie in der Fachinformation.
Hinweis zur Erstattungssituation: Bei der Verordnung von Sunosi® für Patienten mit EDS bei Narkolepsie werden die Kosten für das Präparat den Regelungen des SGB V entsprechend grundsätzlich von der gesetzlichen Krankenversicherung (GKV) übernommen. Der Unterausschuss Arzneimittel des G-BA hat (in seiner Sitzung am 11. August 2020) die Einleitung eines Stellungnahmeverfahrens zur Änderung der Arzneimittel-Richtlinie (Anlage III (Verordnungseinschränkungen und – ausschlüsse) – Nummer 44 Stimulantien) beschlossen. Nach Abschluss des Verfahrens und einem positiven Beschluss des G-BA, wäre eine Erstattung von Sunosi® durch die GKV (nach der Veröffentlichung im Bundesanzeiger) auch im Bereich der EDS bei OSA gewährleistet.
—
Über Sunosi® (Solriamfetol)
Im Jahr 2014 erwarb Jazz Pharmaceuticals von Aerial Biopharma LLC eine Lizenz zur Entwicklung und Vermarktung von Solriamfetol. Jazz Pharmaceuticals verfügt über weltweite Entwicklungs-, Herstellungs- und Vermarktungsrechte für Solriamfetol, mit Ausnahme bestimmter Gerichtsbarkeiten in Asien. SK Biopharmaceuticals Co., Ltd., ist Entdecker des Wirkstoffs und unterhält Rechte in 12 asiatischen Märkten, darunter Korea, China und Japan. Sunosi® hat in den USA Orphan Drug-Status für Narkolepsie.
Sunosi® wurde am 18. Mai 2020 auf dem deutschen Markt eingeführt. Am 20. Januar 2020 wurde es von der Europäischen Kommission zur Verbesserung der Wachheit und zur Verringerung der EDS bei Erwachsenen mit Narkolepsie (mit oder ohne Kataplexie) oder OSA, deren EDS nicht zufriedenstellend durch primäre Therapien der OSA behandelt werden konnte, wie z. B. kontinuierlicher positiver Atemwegsdruck (CPAP), zugelassen. Sunosi® wurde in den einmal täglichen Dosierungen 75 mg und 150 mg für Menschen mit Narkolepsie sowie in den Stärken 37,5 mg, 75 mg und 150 mg für Menschen mit OSA zugelassen. Sunosi® erhielt zuvor durch die Food and Drug Administration am 20. März 2019 die Zulassung zur Verbesserung der Wachheit bei erwachsenen Menschen mit EDS im Zusammenhang mit Narkolepsie oder OSA. Am 17. Juni 2019 wurde es von der USArzneimittelbehörde (Drug Enforcement Agency, DEA) als Arzneimittel der Liste IV eingestuft.10,20
Über Narkolepsie
Narkolepsie ist eine beeinträchtigende chronische neurologische Erkrankung, die u.a. durch Exzessive Tagesschläfrigkeit und die Unfähigkeit den normalen Schlaf-Wach-Rhythmus zu regulieren, gekennzeichnet ist.21 Narkolepsie ist mit einer geschätzten Prävalenz von 0,02 % in Europa sehr selten.9 Studien zeigten, dass es zehn oder mehr Jahre dauern kann, bis Menschen mit Narkolepsie eine Diagnose erhalten. Es wird geschätzt, dass mehr als 50 % der an Narkolepsie Erkrankten noch nicht diagnostiziert wurden.10,20,22 Es gibt fünf Kernsymptome der Narkolepsie: EDS, Kataplexie, schlafbezogene Halluzinationen, Schlaflähmung und Schlafstörungen.10 Während alle Patienten mit Narkolepsie auch an EDS leiden, treten möglicherweise aber nicht alle fünf Symptome gemeinsam auf. 23
Über obstruktive Schlafapnoe und EDS
Die obstruktive Schlafapnoe (OSA), gemeinhin als Schlafapnoe bezeichnet, ist eine weit verbreitete Erkrankung, von der etwa 16 Millionen Menschen in der EU bis zu einem gewissen Grad betroffen sind.24 Exzessive Tagesschläfrigkeit (EDS), ein Hauptsymptom der OSA, ist gekennzeichnet durch die Unfähigkeit, tagsüber wach und aufmerksam zu bleiben, was zu ungeplanten Schlafattacken und Schläfrigkeit führt.23,25 Die Therapie mit positivem Atemwegsdruck, deren häufigste Form kontinuierlicher positiver Atemwegsdruck (CPAP) ist, hat sich als wirksame Therapie der Schlafapnoe erwiesen, die häufig zu einer Verbesserung der EDS führt.24,26 Jedoch vertragen nicht alle Patienten die CPAP-Therapie, und bei denjenigen, die CPAP vertragen, variiert die Compliance stark.27,28,29 Menschen mit OSA können also weiterhin an EDS leiden.1,30
Über Jazz Pharmaceuticals
Jazz Pharmaceuticals plc (Nasdaq: JAZZ) ist ein internationales biopharmazeutisches Unternehmen, das sich der Entwicklung lebensverändernder Medikamente widmet, um Menschen mit wenigen oder keinen Optionen ein erfüllteres Leben zu ermöglichen. Jazz verfügt über ein breit gefächertes Portfolio an Medikamenten und Substanzen, die sich noch im Entwicklungsstadium befinden. Unser Fokus liegt auf der Neurowissenschaft, einschließlich der Schlafmedizin und Bewegungsstörungen, sowie in der Onkologie, einschließlich hämatologischer und solider Tumoren. Wir prüfen revolutionäre Arzneimitteloptionen – angefangen bei der Fortentwicklung niedermolekularer Substanzen bis hin zu Biopharmazeutika (Biologika) und der Entwicklung innovativer Präparate. Jazz hat seinen Hauptsitz in Dublin, Irland, und beschäftigt weltweit ca. 1.8 00 Mitarbeiter, die Patienten in mehr als 90 Ländern betreuen.
Literaturverweise
- Gasa M et al. J Sleep Res. 2013; 22, 389-397.
- Mayer G et al. S3-Leitlinie Somnologie 2017; 20 (Suppl s2): 97-180.
- Stuck et al. Teilaktualisierung S3-Leitlinie Somnologie 2020; 24: 176-208.
- Guilleminault, C und Brooks, SN Brain 2001; 124(Pt 8): 1482-1491.
- Smolensky, MH et al. Accident Analysis and Prevention 2011; 43: 533-548.
- Jennum, P et al. Acta Neurol Scand 2011; 121: 265-270.
- Waldman, LT et al. Poster präsentiert auf SLEEP 2018. The 32nd Annual meeting of the Association Professional Sleep Societies (APSS); 2018 June 2–6, Baltimore, MD, Figure 1. Demographic and Health Characteristics
- Mulgrew, A et al. Sleep Medicine 2007; 9: 42-53.
- Khatami, R et al. J Sleep Res 2016; 25(3): 356-364.
- Ahmed, I und Thorpy, M Clin Chest Med. 2010; 31(2): 371-381.
- Schwartz, JRL et al. Prim Care Companion J Clin Psychiatry 2009; 11: 197-204.
- Littner, MR et al. Sleep 2005; 28(1): 113-121.
- 13 Johns, M. Sleep 1991; 14(6): 540-545.
- Fachinformation Sunosi, Stand Januar 2020.
- Overeem, S et al. J Clin Neurophysiol 2001; 18: 78-105.
- Thorpy, MJ et al. Ann Neurol 2019; 85: 359-370.
- Schweitzer, PK et al. Am J Respir Crit Care Med 2019; 199:1421-1431.
- Strollo, PJ et al. Chest 2019; 155(2): 364-374.
- Malhotra, A et al. Sleep 2019; 42 Supplement: 1-474.
- Kryger, MH und Walid R, Manfreda, J Sleep 2002; 25(1): 36-41.
- Thorpy, M und Krieger, A Sleep Medicine 2014; 15(5): 502-507.
- Parkes, JD et al. J Neurol Neurosurg Psychiatry 1995; 59: 221-224.
- American Academy of Sleep Medicine. The International Classification of Sleep Disorders. Third Edition (ICSD-3).
- Young, T et al. American Journal of Respiratory and Critical Care Medicine 2002; 165(9): 1217- 1239.
- Ahmed I und Thorpy, M ed. Cambridge University Press. 2011; 36-49.
- Serrano Merino, J et al. Biol Res Nurs. 2018; 20: 452-461.
- Habukawa, M, Uchimura und N, Kakuma, T., Sleep Med 2010; 11: 552-557.
- Weaver, T und Grunstein R, Proc Am Thorac Soc 2008; 5: 173-178.
- Stepnowsky, C und Moore, P, J Psychosom Res 2003; 54(6): 599-605.
- Pépin, JL, Viot-Blanc, V und Escourrou, P et al. Eur Respir J. 2009; 33: 1062-1070.
Abkürzungen
| CPAP | Continuous Positive Airway Pressure (kontinuierlicher positiver Atemwegsdruck) |
| DEA | Drug Enforcement Agency (US-Arzneimittelbehörde) |
| DNRI | Dopamine and Norepinephrine-reuptake Inhibitor (dualer Dopamin- und Noradrenalin-Wiederaufnahmehemmer) |
| EDS | Excessive Daytime Sleepiness (Exzessive Tagesschläfrigkeit) |
| ESS | Epworth Sleepiness Scale (Epworth-Schläfrigkeitsskala) |
| FDA | Food and Drug Administration (Amerikanische Behörde für Lebens- und Arzneimittel) |
| MSLT | Multiple Sleep Latency Test (Multipler Schlaflatenztest) |
| MWT | Maintenance of Wakefulness Test (Multipler Wachbleibetest) |
| OSA | Obstructive Sleep Apnea (Obstruktive Schlafapnoe) |
| RLS | Restless-Legs-Syndrom (Syndrom der ruhelosen Beine) |
| TONES
|
The Treatment of Obstructive sleep apnea and Narcolepsy Excessive
Sleepiness (Studienprogramm zur Behandlung der übermäßigen Tagesschläfrigkeit bei obstruktiver Schlafapnoe und Narkolepsie) |
Quelle: Jazz Pharmaceuticals, 20.11.2020 (tB).
Schlagwörter: Jazz Pharmaceuticals, Narkolepsie, Obstruktive Schlafapnoe, Schlafmedizin, Solriamfetol, Sunosi®


