MEDIZIN
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Therapie der pulmonal arteriellen Hypertonie (PAH)
Kölner Konsensus-Konferenz plädiert für frühe Kombinationstherapie nach Risikostratifizierung
Mannheim (20. April 2017) – Die Einführung der Risikostratifizierung gilt als eine der wesentlichen Neuerungen der aktualisierten ESC-/ERS-Leitlinien zur pulmonalen Hypertonie (PH) [1]. Das bestätigen auch die Experten-Empfehlungen der 2. Kölner Konsensus-Konferenz [2], die die Leitlinien unter klinisch-praktischen sowie unter länderspezifischen Aspekten kommentieren. „Die individuelle Risikoabschätzung ist für die Prognoseeinstufung und die Therapieplanung bei PAH ein wesentliches Werkzeug“, so Prof. Dr. Stephan Rosenkranz, Köln anlässlich eines Meet-the-Expert-Gesprächs von Actelion Deutschland.
Das Ziel der PAH-Therapie ist es, möglichst jeden Patienten in den „Niedrigrisikobereich“ (1-Jahresmortalität < 5 %) zu führen. „Mit der Empfehlung für eine frühe initiale bzw. sequentielle Kombinationstherapie haben wir gute Voraussetzungen an der Hand, um dieses Ziel auch zu erreichen“, kommentiert Prof. Dr. Ardeschir Ghofrani, Gießen. Als möglicher Kombinationspartner zu einem Phosphodiesterase 5- (PDE 5-) Inhibitor hat sich in der klinischen Anwendung z. B. der orale duale Endothelin-Rezeptor-Antagonist (ERA) Macitentan (Opsumit®) bewährt. Zur weiteren Therapieeskalation steht mit Selexipag (Uptravi®) der oral verfügbare IP-Prostacyclin-Rezeptor-Agonist bereit.
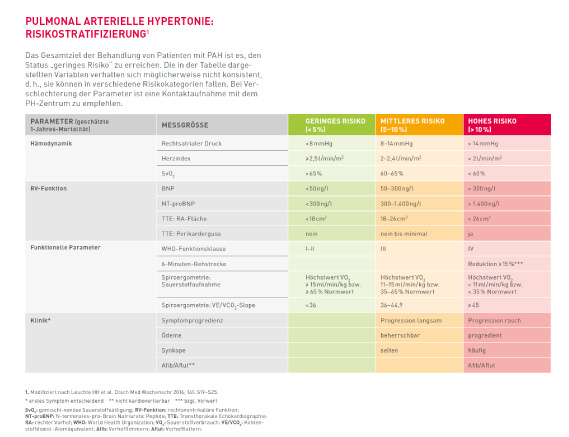
Zur Risikostratifizierung wird die zu erwartende 1-Jahres-Mortalität herangezogen. Dabei werden die Patienten in drei verschiedene Risikoklassen unterteilt: niedriges Risiko mit einer zu erwartenden 1-Jahres-Mortalität unter 5 %, intermediäres Risiko mit 5 – 10 % und hohes Risiko mit > 10 %-igem Risiko. Die Einstufung hängt von verschiedenen Parametern wie z. B. Klinik, funktionellen (u.°a. 6-Minuten-Gehtest) und vor allem hämodynamischen Parametern (rechtsatrialer Druck, Herzindex, SvO2) ab. „Wir haben den Stellenwert der invasiven Hämodynamik in der Tabelle zur Risikostratifizierung modifiziert. Damit soll verdeutlicht werden, welche hohe Priorität diesem „harten“ Parameter bei der Therapieentscheidung zukommt“, erläutert Rosenkranz (>> Abb. 1).
PAH-Therapie: Früh kombinieren – beizeiten eskalieren
Die Therapieentscheidung bei PAH erfolgt in Abhängigkeit von klinischem Schweregrad und individuellem Risiko mit dem Gesamtziel, den Patienten in den Status „geringes Risiko“ zu führen (Abb. 2). „Typische PAH-Patienten, mit niedrigem oder intermediärem Risiko sollten dazu aufgrund der eindeutigen Evidenz konsequent mit einer initialen oder schnell sequentiellen dualen Kombination aus einem ERA und einem PDE 5-Inhibitor bzw. sGC-Stimulator behandelt werden“, so Rosenkranz. Bei atypischen PAH-Patienten, d. h. Patienten mit eindeutig präkapillärer PAH, aber einem Risikoprofil bzw. Begleiterkrankungen wie bei Patienten mit Linksherz-bzw. Lungenerkrankungen, ist zunächst eine Monotherapie zu erwägen, die jedoch bei inadäquatem Ansprechen zügig eskaliert werden sollte. Als Monotherapeutikum sowie als möglicher Kombinationspartner eignet sich der orale duale Endothelin-Rezeptor-Antagonist (ERA) Macitentan (Opsumit®), der sich seit drei Jahren klinisch bewährt. Der ERA, dessen Wirksamkeit und Verträglichkeit in der zulassungsrelevanten Langzeitstudie SERAPHIN* [3] nachgewiesen wurde, reduziert bei PAH-Patienten, die bereits stabil auf eine spezifische Therapie mit einem PDE-5-Inhibitor eingestellt sind, das relative Risiko für den Eintritt des primären kombinierten Endpunktes Morbidität/Mortalitäta um 38 % (p < 0,009) gegenüber Placebo [3]b. Neu diagnostizierte Patienten (Diagnose < 6 Monate vor Studieneintritt zurückliegend, Post-hoc-Analyse) profitieren in der Gesamtbetrachtungc laut Subgruppenanalyse von einer relativen Risikoreduktion im primären Endpunkta um 57% [4].
Tripel-Partner bei anhaltendem intermediärem Risiko
PAH-Patienten, die sich trotz einer kombinierten Therapie mit ERA- und PDE 5-Inhibitoren bzw. sGC-Stimulator im intermediären Risikobereich befinden, sollten laut Kölner Konsensus-Konferenz eine Therapieoptimierung bzw. –erweiterung erhalten. Als Tripel- Kombinationspartner wird mit Evidenzgrad IB [1] z. B. Selexipag (Uptravi®) in den Leitlinien empfohlen. Der IP-Prostacyclin-Rezeptor-Agonist ermöglicht erstmals eine orale Tripel- Kombination bei Patienten mit inadäquatem Ansprechen auf eine duale Kombinationstherapie. In der Zulassungsstudie (GRIPHON**) reduzierte Selexipag das Morbiditäts-/Mortalitäts-Risikod signifikant um 40 % (p < 0,0001) gegenüber Placebo, wobei 80 % der Patienten bereits auf eine PAH-Medikation eingestellt waren [5].
Selexipag wird somit eingesetzt, um die Krankheitsprogression zu verzögern. „Patienten können erstmalig von einer orale Triple-Therapie profitieren.“, betont Ghofrani.

Abb. 1

Abb. 2: THERAPIEALGORITHMUS BEI PAH
Anmerkungen
- *Study with an Endothelin Receptor Antagonist in Pulmonary arterial Hypertension to Improve cliNical outcome
- **Prostacyclin (PGI2) Receptor agonist In Pulmonary arterial HypertensiON
a) Primärer kombinierter Endpunkt: Zeit bis zum Auftreten des ersten Morbiditäts- oder Mortalitätsereignisses bis Behandlungsende. Endpunktkriterien: Tod, atriale Septostomie, Lungentransplantation, Beginn einer Prostanoid-Therapie (i. v. oder s. c.) oder eine andere näher definierte PAH-Verschlechterung. Die Studie war hinsichtlich der Mortalität nicht signifikant.
b) In der Kombinationstherapie war die Placebo-Gruppe bis Studieneinschluss vorbehandelt.
c) Bis Studieneinschluss war die Placebo-Gruppe in der Monotherapiegruppe therapienaiv, in der Kombinationsgruppe vorbehandelt.
d) Beurteilt anhand des zusammengesetzten primären Endpunkts, die Ergebnisse gelten nicht für die Mortalität alleine.
Literatur
- Galiè et al. Eur Heart J. 2016 Jan 1;37(1):67-119.
- Rosenkranz S et al. Dtsch Med Wochenschr 2016;141:1778-1782.
- Pulido T et al. N Engl J Med 2013;369 (9): 809– 818.
- Simonneau G et al. Eur Respir J 2015 Dec;46 (6).
- Sitbon O et al. N Engl J Med 2015; 373: 2522-33.
ÜBER OPSUMIT® (MACITENTAN)
Opsumit (Macitentan) ist ein oraler Endothelin-Rezeptor-Antagonist, der in einem zielgerichteten Entdeckungsprozess in den Labors von Actelion entwickelt wurde.
In den USA ist Opsumit für die Behandlung von PAH der WHO-Gruppe I zur Verzögerung der Krankheitsprogression zugelassen. Zur Krankheitsprogression zählen: Tod, Beginn einer Behandlung mit intravenös (IV) oder subkutan verabreichten Prostanoiden, Verschlechterung der klinischen Befunde der PAH (Verminderung der Wegstrecke beim 6-Minuten-Gehtest, Verschlechterung der Symptome der PAH sowie Notwendigkeit zusätzlicher Therapie der PAH). Im Zusammenhang mit Opsumit waren zudem weniger Hospitalisierungen infolge PAH erforderlich.
Die Wirksamkeit wurde in einer Langzeitstudie mit PAH-Patienten erhoben, bei denen vorwiegend Symptome der WHO-Funktionsklassen II bis III auftraten und die durchschnittlich zwei Jahre lang behandelt wurden. Die Patienten erhielten entweder Opsumit als Monotherapie oder in Kombination mit Phosphodiesterase-5-Inhibitoren oder inhalativen Prostanoiden. Die Patienten waren entweder an idiopathischer oder erblich bedingter PAH (57%), PAH infolge von Bindegewebserkrankungen (31%) oder PAH in Verbindung mit einem korrigierten angeborenen Herzfehler (8%) erkrankt.
In Europa ist Opsumit als Mono- oder Kombinationstherapie für die langfristige Behandlung von PAH bei erwachsenen Patienten mit WHO-Funktionsklasse (FC) II bis III indiziert. Die Wirksamkeit wurde in einer Population von Patienten mit idiopathischer und erblich bedingter PAH, PAH infolge von Bindegewebserkrankungen sowie PAH in Verbindung mit einem korrigierten angeborenen Herzfehler aufgezeigt.
Es besteht eine hohe Wahrscheinlichkeit dafür, dass Opsumit schwere Geburtsschäden hervorruft. Es ist für die Anwendung in der Schwangerschaft kontraindiziert. In den USA wird Opsumit im Rahmen einer Risikomanagementstrategie (Risk Evaluation und Mitigation Strategy) vertrieben.
VERFÜGBARE KLINISCHE DATEN
SERAPHIN, eine globale, zulassungsrelevante Phase-III-Studie, war darauf ausgelegt, die Wirksamkeit und Anwendungssicherheit von Macitentan bei Patienten mit symptomatischer PAH zu evaluieren. Als primärer Endpunkt wurde die Zeit bis zum Eintreten des ersten Ereignisses hinsichtlich Morbidität und Gesamtmortalität festgelegt. Insgesamt 742 Patienten erhielten randomisiert entweder Placebo (n=250), 3 mg Macitentan (n=250) oder 10 mg Macitentan (n=242). Der primäre Endpunkt wurde bei 46,4%, 38,0% und 31,4% der Patienten in der entsprechenden Gruppe erreicht. Das Hazard Ratio für 3mg Macitentan gegenüber Placebo lag bei 0,70 (97,5% Konfidenzintervall, 0,52 bis 0,96; p=0,0108), das Hazard Ratio für 10 mg Macitentan gegenüber Placebo lag bei 0,55 (97,5% Konfidenzintervall, 0,39 bis 0,76; p<0,0001). Eine Verschlechterung der pulmonalen arteriellen Hypertonie war das beim primären Endpunkt am häufigsten auftretende Ereignis. Die Verabreichung einer PAH-spezifischen Grundmedikation in Form eines PDE-5-Inhibitors oder oraler/inhalierter Prostanoide während der Studie war gestattet. Die Wirkung von Macitentan auf diesen Endpunkt wurde unabhängig davon beobachtet, ob eine Grundtherapie der pulmonalen arteriellen Hypertonie erfolgte. Die häufigsten beobachteten Nebenwirkungen bei einer Behandlung mit Opsumit waren Nasopharyngitis (Entzündungen des Nasenraums) (14,0%), Kopfschmerzen (13,6%) und Anämie (13,2%).
MERIT war eine randomisierte Kontrollstudie zur Ermittlung der Wirksamkeit und Sicherheit von Macitentan bei Patienten mit inoperabler chronisch thromboembolischer pulmonaler Hypertonie (CTEPH). In der MERIT-Studie wurden 80 inoperable Patienten über einen Zeitraum von 24 Wochen im Verhältnis von 1:1 in zwei Gruppen entweder mit 10 mg Macitentan oder mit Placebo behandelt. Der Behandlungseffekt nach 16 Wochen zeigte sich in einer signifikanten (16%) Abnahme des pulmonalen Gefässwiderstands (PVR) bei Macitentan im Vergleich zu Placebo (95% CL: -30%, -1%; p=0,04 Intention-to-Treat-Analyse). Die beobachtete Wirksamkeit war über alle Behandlungsgruppen hinweg konstant, auch für Patienten, die eine PH-spezifische Grundtherapie erhielten (61%), einschliesslich PDE-5-Inhibitoren (59%). Der mittlere pulmonale Gefässwiderstand zeigte im Vergleich zum Ausgangswert sowohl für die Macitentan- als auch für die Placebo-Gruppe eine Abnahme (geometrisches Mittel der Prozentanteile in Woche 16 gegenüber dem Ausgangswert jeweils 73,0% bzw. 87,2%). Die Studie zeigte zudem einen signifikanten positiven Effekt von Macitentan auf die körperliche Belastbarkeit, im Vergleich zu Placebo. Nach einer Behandlungsdauer von 24 Wochen betrug die durchschnittliche Zunahme der Wegstrecke beim 6-Minuten- Gehtest (6MWD) im Vergleich zum Ausgangswert 35 Meter (m) bei Macitentan und 1 m bei Placebo. Die nach der Methode der kleinsten Quadrate für Macitentan und Placebo ermittelte 6-MWD-Mittelwertdifferenz in Woche 24 betrug 34,0 Meter (95% CL: 2,9, 65,2 m; p=0,03). Macitentan wurde in dieser Patientenpopulation gut vertragen, und die relevanten Daten entsprachen dem aus vorangegangenen klinischen Studien bekannten Sicherheitsprofil. Die häufigsten Nebenwirkungen, die öfter unter Macitentan als unter Placebo auftraten, waren periphere Ödeme (22,5% gegenüber 10,0%) und Nebenwirkungen in Zusammenhang mit Anämie (17,5% gegenüber 2,5%). Ein Abfall des Hämoglobin-Wertes wurde sowohl in der Macitentan- als auch in der Placebo-Gruppe beobachtet. Nur bei jeweils einem Patienten in jeder Gruppe sank während der Studie der Hämoglobinwert auf unter 100 g/L.
Macitentan wird derzeit in verschiedenen klinischen Studien im Hinblick auf die Ausweitung des klinischen Nutzens dieses wichtigen Präparats auf weitere PAH-Indikationen und darüber hinaus untersucht.
Über Selexipag
Selexipag wurde ursprünglich von Nippon Shinyaku entdeckt und synthetisiert und ist ein Prostacyclin-IP-Rezeptor- Agonist. Es gehört nicht zu den Prostanoiden, von denen es sich chemisch und strukturell klar unterscheidet. Selexipag und sein aktiver Metabolit besitzen eine hohe Affinität und Selektivität für den IP-Rezeptor im Vergleich zu anderen Prostanoid-Rezeptoren. Die Stimulation des IP-Rezeptors durch Selexipag und seinen aktiven Metaboliten führt zur Vasodilatation sowie zur Hemmung von Zellproliferation. Selexipag verhindert im Rattenmodell der PAH ein kardiales und pulmonales Remodelling und führt zu einer proportionalen Abnahme des pulmonalen und peripheren Drucks. Wissenschaftliche Daten zeigen, dass Selexipag in vitro im Rattenmodell weder eine Desensibilisierung des IP-Rezeptors noch eine Tachyphylaxie bewirkt.
Zulassungsstatus
Bereits zugelassen ist Selexipag in den USA (21.12.2015), Kanada (21.01.2016), Neuseeland (17.03.2016), Australien (18.03.2016) und Südkorea (11.05.2016). Die Zulassung durch die Europäische Kommission erfolgte am 12.05.2016.
Über den Prostacyclin-Signalweg
Bei bestimmten Erkrankungen ist die Produktion von Prostacyclin durch das Endothel beeinträchtigt, was dazu führt, dass zum Beispiel die schädlichen Effekte von im Übermaß ausgeschüttetem Endothelin oder Thromboxan dominieren. Der Prostacyclin-Signalweg ist einer der drei am besten charakterisierten Signalwege in der Pathophysiologie und Therapie der PAH. Prostacyclin ist ein Prostanoid, das als Signalmolekül im menschlichen Körper fungiert. Wie andere vasoaktive Substanzen wird Prostacyclin von den Endothelzellen produziert. Es wirkt gefäßerweiternd, antiproliferativ, entzündungshemmend und unterbindet die Blutplättchen-Aggregation.
Über PAH
Pulmonal arterielle Hypertonie (PAH) ist eine chronische, lebensbedrohliche Erkrankung, die durch einen erhöhten Blutdruck in den Arterien zwischen Herz und Lunge der betroffenen Patienten gekennzeichnet ist. Die Symptome der PAH sind unspezifisch und reichen von leichter Atemnot und Müdigkeit beim Verrichten normaler täglicher Aktivitäten bis hin zu Rechtsherzversagen und schwerwiegender Beeinträchtigung der körperlichen Leistungsfähigkeit und schließlich einer verkürzten Lebensdauer.
PAH ist eine Untergruppe der pulmonalen Hypertonie (PH). Zu dieser Untergruppe gehören die idiopathische PAH, die erblich bedingte PAH und PAH infolge Bindegewebserkrankungen, HIV-Infektion und angeborener Herzkrankheit.
In den letzten zehn Jahren wurden bedeutende Fortschritte in Bezug auf das Verständnis der Pathophysiologie der PAH gemacht, die mit der Entwicklung von Behandlungsrichtlinien und neuen Therapien einhergingen. Zu den Arzneimitteln, die auf die drei an die Pathogenese der PAH beteiligten Signalwege ausgerichtet sind, zählen Endothelin-Rezeptor-Antagonisten (ERA), Prostacyclin-Analoga, Prostacyclin-Rezeptor-Agonisten, Phosphodiesterase-5-Inhibitoren und lösliche Guanylatcyclaseinhibitoren. Dank verfügbarer PAH-Therapeutika hat sich die Prognose für PAH-Patienten von einer symptomatischen Verbesserung der Belastungstoleranz vor zehn Jahren hin zu einer verzögerten Krankheitsprogression heute verändert. Das verbesserte Verständnis der Krankheit und evidenzbasierte Richtlinien, die anhand der Erkenntnisse aus randomisierten klinischen Studien entwickelt wurden, legen eine frühzeitige therapeutische Intervention, eine zielgerichtete Behandlung und eine Kombi-nationstherapie nahe.
ACTELION LTD
Actelion Ltd. ist ein führendes biopharmazeutisches Unternehmen, das sich auf die Entdeckung, Entwicklung und Vermarktung innovativer Medikamente für Krankheiten mit hohem medizinischem Bedarf konzentriert. Actelion ist wegweisend auf dem Gebiet der pulmonal arteriellen Hypertonie (PAH). Das PAH-Portfolio des Unternehmens deckt das Krankheitsspektrum der WHO-Funktionsklassen II bis IV ab und umfasst Medikamente zur oralen, inhalierbaren und intravenösen Therapie. Actelion verfügt zudem über behördlich zugelassene, jedoch nicht in allen Ländern erhältliche, Therapien für eine Reihe von Krankheiten, die durch Spezialisten behandelt werden. Hierzu zählen Typ-1-Gaucher-Krankheit, Niemann-Pick-Krankheit Typ C, digitale Ulzerationen bei Patienten mit systemischer Sklerose sowie Mycosis fungoides vom Typ kutanes T-Zell-Lymphom.
Das Unternehmen wurde Ende 1997 gegründet und beschäftigt inzwischen über 2.400 engagierte Fachkräfte. Actelion ist in allen wichtigen Märkten der Welt präsent, darunter Europa, die USA, Japan, China, Russland und Mexiko. Der Hauptsitz des Unternehmens befindet sich in Allschwil / Basel, Schweiz.
Actelion Aktien werden an der SIX Swiss Exchange als Titel des Blue-Chip-Index SMI (Swiss Market Index SMI®) gehandelt (Symbol: ATLN). Alle Markennamen sind rechtlich geschützt.
Quelle: Actelion, 20.04.2017 (tB).