PHARMAKOLOGIE
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Auf dem Weg zum Proteindesign
 Saarbrücken (7. Januar 2009) – Wie wirken sich Mutationen auf die Stabilität und die Bindungseigenschaften von Proteinen aus? – Eine schnelle Methode zur präzisen Vorhersage des Effektes von Mutationen hat jetzt ein internationales Team von Wissenschaftlern des Zentrums für Bioinformatik der Universität des Saarlandes, des Max-Planck Instituts für biophysikalische Chemie in Göttingen sowie der Universität Zürich entwickelt.
Saarbrücken (7. Januar 2009) – Wie wirken sich Mutationen auf die Stabilität und die Bindungseigenschaften von Proteinen aus? – Eine schnelle Methode zur präzisen Vorhersage des Effektes von Mutationen hat jetzt ein internationales Team von Wissenschaftlern des Zentrums für Bioinformatik der Universität des Saarlandes, des Max-Planck Instituts für biophysikalische Chemie in Göttingen sowie der Universität Zürich entwickelt.
Die neue Methode erlaubt es, Einblicke in die spezifische Bindung von Proteinen zu gewinnen und ermöglicht auch das gezielte Design von Proteinen am Rechner. Von einem verbesserten Verständnis von Proteinkomplexen könnte zukünftig auch die medizinische Forschung profitieren, denn das neue computergestützte Design kann bei der Entwicklung von Wirkstoffen wertvolle Dienste leisten.
Proteine besitzen eine komplexe dreidimensionale Struktur, die von ihrer Sequenz, das heißt der Aneinanderreihung einer bestimmten Abfolge von Aminosäuren, bestimmt wird. Die Proteinoberfläche bestimmt wesentlich die Wechselwirkungen von Proteinen untereinander – essentiell für die Funktion der Zelle, aber auch für die Entwicklung von Krankheiten.
Für das Design von Proteinen und Wirkstoffen ist es wichtig zu wissen, wie stark die einzelnen Aminosäuren die Bindungsstärke innerhalb eines Komplexes aus verschiedenen Proteinen beeinflussen. Diese Kenntnisse können in begrenztem Umfang aus teuren Experimenten gewonnen werden, indem einzelne Aminosäuren ausgetauscht werden und die Änderung der Bindungsstärke durch diese Mutation gemessen wird. Auch verlässliche theoretische Vorhersagen waren bisher sehr zeitintensiv und damit in vielen Fällen kaum anwendbar.
In einer Kooperation mit Instituten aus Göttingen und Zürich konnte nun die Arbeitsgruppe von Dr. Rainer Böckmann am Zentrum für Bioinformatik der Saar-Universität eine neue Computer-gestützte Methode entwickeln, welche die Vorhersage bei vergleichbarer Qualität etwa um den Faktor einhundert beschleunigt und daher ausgedehnte Untersuchungen erlaubt. Ihre Stärke: Bei den Berechnungen wird die innere Flexibilität der Proteinstrukturen effizient berücksichtigt und mit einer speziellen Funktion kombiniert, welche die physikalischen Kräfte zwischen den Atomen der Proteine beinhaltet. Mit ihrer Hilfe kann die Stabilität von Proteinen und Proteinkomplexen sehr schnell und präzise bestimmt werden.
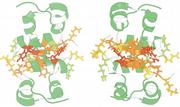
In einer ersten Machbarkeitsstudie wurde die Oberfläche des Hormons Insulin analysiert auf der Suche nach Mutationen, welche die Bindungskräfte innerhalb des Protein-Komplexes abschwächen. Der Grund: Insulin kann nur als isoliertes Protein den Blutzuckerspiegel senken. Bei hohen Insulinkonzentrationen, wie sie bei der Behandlung von Diabetis mellitus-Patienten verwendet werden, bilden die Insulin-Moleküle aber Komplexe, die den Wirkmechanismus des Hormons verzögern. Einige in der Praxis verwendete Insulin-Mutanten verhindern die Komplexbildung und können somit sehr schnell den Blutzuckerspiegel senken. Diese so genannten schnellen Insulin-Analoga konnten korrekt mit der neu entwickelten Methode reproduziert werden, neue eventuell verbesserte Insulin-Mutanten wurden entwickelt.
Originalveröffentlichung
Benedix, A., Becker, C.M., de Groot, B.L., Caflisch, A., Böckmann, R.A.: Predicting Free Energy Changes Using Structural Ensembles. Nature Methods 6 (2009) 3-4

Abb.: Die Aminosäuren an der Grenzfläche zwischen den beiden Proteinen sind als stabförmige Strukturen hervorgehoben. Der Einfluss dieser Aminosäuren auf die Bindungsstärke wurde mit Hilfe einer neu entwickelten Methode berechnet und ist farblich kodiert dargestellt von grün (kein Einfluss) nach rot (starke Absenkung der Bindungsstärke zwischen den Insulin-Proteinen).
Quelle: Pressemitteilung der Universität des Saarlandes vom 07.01.2009.