PHARMAKOLOGIE
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Eculizumab
Therapieoption für die Behandlung der Paroxysmalen Nächtlichen Hämoglobinurie (PNH)
 Duisburg (19. Juni 2009) – Mit dem rekombinanten monoklonalen Antikörper Sollris® (Eculizumab) greift erstmals eine Therapie kausal in den Pathomechanismus der PNH ein. 2008 erhielt Soliris® den Prix Gallen in den USA als bestes Biotechnologie‑Produkt. Für die seltene Blutkrankheit mit einer geschätzten Prävalenz von etwa 8 bis 16: 1.000.000 standen bisher nur symptomorientierte Therapien zur Verfügung (1). Die erworbene, klonale, chronisch verlaufende und lebensbedrohliche Erkrankung führt zu einem erhöhten Risiko für lebensbedrohliche thromboembolische Komplikationen. Hauptursache für die Morbidität und Mortalität ist die chronische Hämolyse (4,10).
Duisburg (19. Juni 2009) – Mit dem rekombinanten monoklonalen Antikörper Sollris® (Eculizumab) greift erstmals eine Therapie kausal in den Pathomechanismus der PNH ein. 2008 erhielt Soliris® den Prix Gallen in den USA als bestes Biotechnologie‑Produkt. Für die seltene Blutkrankheit mit einer geschätzten Prävalenz von etwa 8 bis 16: 1.000.000 standen bisher nur symptomorientierte Therapien zur Verfügung (1). Die erworbene, klonale, chronisch verlaufende und lebensbedrohliche Erkrankung führt zu einem erhöhten Risiko für lebensbedrohliche thromboembolische Komplikationen. Hauptursache für die Morbidität und Mortalität ist die chronische Hämolyse (4,10).
Charakterisiert ist die PNH durch die klinische Trias hämolytische Anämie, thrombophile Diathese und hämatopoietische Insuffizienz (10). Bei Diagnosestellung haben die meisten Patienten Anämiesymptome, etwa ein Drittel der Patienten berichtet über Hämoglobinurie und etwa 6 % der Patienten haben bereits mindestens ein thromboembolisches Ereignis erlitten. Thromboembolische Ereignisse sind die Haupttodesursache bei PNH. Die Symptome der PNH sind fluktuierend und interindividuell variabel (2,11).
Zentral für die Entstehung der Symptome der PNH ist die chronische Hämolyse. Während gesunde Menschen gegen pathologische Auswirkungen einer Aktivierung des Komplementsystems durch so genannte komplementregulierende Proteine auf der Oberfläche ihrer Zellen geschützt sind, kommt es bei Patienten mit PNH zu einer chronischen Zerstörung ihrer Erythrozyten und daraus folgend zur Freisetzung von Hämoglobin durch Komplement. Soliris® ist die erste Therapie, die in den Prozess der Hämolyse schnell und effektiv eingreift (12,13).

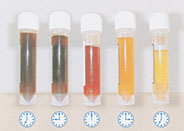
Abb.: Die Hämoglobinurie ist ein Leitsymptom der PNH. Der typische dunkle Morgenurin von PNH-Patienten hat so zur Namensgebung geführt. Es handelt sich hierbei aber um eine chronische Hämolyse, und die morgendliche Dunkelfärbung kommt durch die Konzentrierung des Morgenurins zustande. Die Dunkelfärbung verschwindet meist im Laufe des Tages. Photo: Alexion Pharma
In zwei Phase‑III‑Studien wurden insgesamt 195 transfusionsbedürftige PNH‑Patienten mit Soliris® behandelt. Die Therapie bewirkte eine signifikante, schnelle und anhaltende Reduktion der komplementvermittelten, intravaskulären Hämolyse um bis zu 87 % (12,13). Die Hämoglobinwerte wurden unter Soliris® im Vergleich zu Plazebo stabilisiert und demzufolge der Transfusionsbedarf gesenkt. Erreicht wurde der Anstieg der Hämoglobinwerte durch die Erhöhung der körpereigenen roten Blutkörperchen (14). Auch eine signifikante Verbesserung der Fatigue‑Symptomatik bei den Patienten, die mit Soliris behandelt wurden, konnte anhand zweier verschiedener Messinstrumente, des FACIT‑Scores und der EORTC QLQ‑C30 Fatigue Scales, nachgewiesen warden (13). Die Anzahl an thromboembolischen Ereignissen konnte in normierten Behandlungszeiträumen nicht‑kontrollierter Studien durch Soliris®, je nach betrachteter Patientensubgruppe, um mindestens 85 % reduziert werden(15).
Mit der deutlichen Verbesserung der Beschwerden und der Reduktion von thromboembolischen Ereignissen hat Eculizumab den Verlauf maßgeblich verändert und neue Maßstäbe für die Behandlung von PNH gesetzt.
Über PNH
Die PNH ist eine seltene hämatologische Erkrankung, unter der schätzungsweise 8.000 bis 10.000 Menschen in Nordamerika und Europa leiden, sowie ‑ gemäß vergleichbarer epidemiologischer Daten ‑ potentiell 1.000 bis 2.000 Patienten in Japan (1). Obwohl die PNH alle Altersgruppen betreffen kann, tritt sie häufig bei Menschen im mittleren Erwachsenenalter mit einem durchschnittlichen Manifestationsalter zu Beginn der 3. Lebensdekade auf (2). Etwa 10 Prozent aller Patienten entwickeln die ersten Symptome bereits im Alter von 21 Jahren oder jünger (3). Die PNH tritt plötzlich und bei Männern und Frauen aller Gesellschafts- und Altersgruppen auf. Eine PNH bleibt oft lange unerkannt, mit Verzögerungen der Diagnose von 1 bis zu mehr als 10 Jahren (4). Die geschätzte mittlere Überlebenszeit für PNH‑Patienten liegt zwischen 10 und 15 Jahren ab dem Zeitpunkt der Diagnose (2,4).
Eine PNH wird häufig bei Patienten mit anderen Knochenmarkserkrankungen diagnostiziert, hierunter Aplastische Anämie (AA) und Myelodysplastisches Syndrom (MDS) (5,6,7,8,9). Bei Patienten mit Thrombosen unbekannter Genese kann eine PNH die Ursache sein (3,9).
Vor der Zulassung von Soliris® gab es keine spezifische Therapie für die Behandlung der PNH. Die PNHTherapie war auf eine rein symptomatische Behandlung beschränkt und umfasste u.a. regelmäßige Bluttransfusionen, unspezifische Immunsuppressionstherapie und (in ausgesuchten Fällen) Knochenmarktransplantationen eine Behandlung mit einem beträchtlichen Sterblichkeitsrisiko (3,9).
Über Soliris®
Soliris® wurde im März 2007 von der U.S. Food and Drug Administration (FDA) als die erste Behandlung für PNH zugelassen, eine seltene, schwerwiegende und lebensbedrohliche Blutkrankheit, die durch chronische Hämolyse charakterisiert ist. Im Juni 2007 erteilte auch die Europäische Kommission (EC) die Zulassung für die Anwendung von Soliris® zur Behandlung von Patienten mit PNH. Soliris® ist die erste Therapie, die in Europa für die Behandlung von PNH zugelassen wurde und war das erste Arzneimittel, das die ECZulassung in einem beschleunigten Zulassungsverfahren der EMEA erhielt.
Wichtige Sicherheitsinformationen
Soliris® ist allgemein gut verträglich. Die am häufigsten in den klinischen Studien beobachteten Nebenwirkungen waren Kopfschmerzen, Nasopharyngitis, Übelkeit, Pyrexie, Myalgie, Müdigkeit und Herpes simplex. Eine Behandlung mit Soliris® sollte die Therapie mit Antikoagulantien nicht ändern, da die Auswirkungen eines Abbruchs einer Antikoagulantienmedikation während einer Behandlung mit Soliris® nicht untersucht worden sind.
Die Fachinformation für Soliris® enthält zudem folgenden Warnhinweis: Aufgrund seines Wirkungsmechanismus erhöht Soliris die Anfälligkeit des Patienten für eine Meningokokkeninfektion (Neisseria meningitidis). Zur Verringerung des Infektionsrisikos müssen alle Patienten mindestens 2 Wochen vor der Verabreichung von Soliris geimpft und entsprechend den geltenden medizinischen Impfrichtlinien erneut geimpft werden. Tetravalente Impfstoffe werden besonders empfohlen. Alle Patienten sollten auf Frühzeichen einer Meningokokkeninfektion überwacht, bei Infektionsverdacht sofort untersucht und, falls erforderlich, mit Antibiotika behandelt werden. Die Patienten sollten über diese Anzeichen und Symptome sowie die für eine sofortige ärztliche Behandlung einzuleitenden Schritte informiert werden. Während klinischer Studien erlitten 2 von 196 geimpften PNH‑Patienten, die mit Soliris@ behandelt wurden, eine schwere Meningokokkeninfektion.
Vor Beginn der Soliris®‑Therapie wird allen Patienten und ihren betreuenden Ärzten eine Teilnahme am so genannten „PNH‑Register" vorgeschlagen werden, welches Teil eines speziellen Risikomanagement‑Plans ist, der eine anfängliche und kontinuierliche Weiterbildung sowie langfristige Überwachung zur Erkennung neuer Sicherheitsrisiken umfasst.
Sie finden die vollständigen Verordnungsinformationen unter:
http://www.emea.europa.eu/humandocs/Humans/EPAR/soliris/soliris.htm
Über Alexion
![]() Alexion Pharmaceuticals, Inc. ist ein Biopharmaunternehmen, das lebenswichtige Arzneitherapien für Patienten mit schweren und lebensbedrohlichen Krankheiten entwickelt und bereitstellt. Alexion beschäftigt sich mit der Entdeckung, Entwicklung und Vermarktung von therapeutischen Produkten zur Behandlung von Patienten mit einer Vielfalt schwerer Erkrankungen, darunter hämatologischen Krankheiten, Krebs und Autoimmunerkrankungen. Im März 2007 erteilte die FDA die Marktzulassung für Alexions erstes Produkt Soliris® für alle Patienten mit PNH, und Alexion begann den gewerblichen Vertrieb von Soliris® in den USA im April 2007. Im Juni 2007 erteilte die Europäische Kommission die Marktzulassung für Soliris8 in der Europäischen Union für alle Patienten mit PNH.
Alexion Pharmaceuticals, Inc. ist ein Biopharmaunternehmen, das lebenswichtige Arzneitherapien für Patienten mit schweren und lebensbedrohlichen Krankheiten entwickelt und bereitstellt. Alexion beschäftigt sich mit der Entdeckung, Entwicklung und Vermarktung von therapeutischen Produkten zur Behandlung von Patienten mit einer Vielfalt schwerer Erkrankungen, darunter hämatologischen Krankheiten, Krebs und Autoimmunerkrankungen. Im März 2007 erteilte die FDA die Marktzulassung für Alexions erstes Produkt Soliris® für alle Patienten mit PNH, und Alexion begann den gewerblichen Vertrieb von Soliris® in den USA im April 2007. Im Juni 2007 erteilte die Europäische Kommission die Marktzulassung für Soliris8 in der Europäischen Union für alle Patienten mit PNH.
Alexion prüft zur Zeit andere mögliche Indikationen für Soliris® sowie andere Formulierungen von Eculizumab für zusätzliche klinische Indikationen und betreibt die Entwicklung anderer Antikörper in frühen Entwicklungsstadien als mögliche Produktkandidaten.
Literatur
-
(1) Hill A, Platts PJ, Smith A et al. The incidence and prevalence of paroxysmal nocturnal hemoglobinuria (PNH) and survival of patients in Yorkshire [abstract]. Blood. 2006;108(11):985.
-
(2) Socie G, Mary J Yves, de Gramont A, et al. Paroxysmal nocturnal haemoglobinuria: long‑term followup and prognostic factors. Lancet 1996; 348:573‑577.
-
(3) Parker C, Omine M, Richards S, et al. Diagnosis and management of paroxysmal nocturnal hemoglobinuria. Blood. 2005;106:3699‑3709.
-
(4) Hillmen P. Lewis SM, Bessler M, Luzzatto L, Dacie JV. Natural history of paroxysmal nocturnal hemoglobinuria. N Engl J Med 1995; 333:1253‑1258.
-
(5) Johnson RJ, Hillmen P. Paroxysmal nocturnal hemoglobinemia: Nature’s gene therapy? Mol Pathol. 2002;55(3):145‑52.
-
(6) Wang, et al. Clinical significance of a minor population of paroxysmal nocturnal hemoglobinuria‑type cells in bone marrow failure syndrome. Blood 2002;100:3897‑3902.
-
(7) Iwanga, et al. Paroxysmal nocturnal haemoglobinuria clones in patients with myelodysplastic syndromes. Brit J Haem. 1998; 102:465‑474.
-
(8) Maciejewski, et al. Relationship between bone marrow failure syndromes und the presence of glycophosphatidyl inositol‑anchored Protein‑deficient clones. Brit J Haem. 2001;1 15:1015‑1022.
-
(9) Hill A, Richards S, Hillmen P. Recent developments in the understanding and management of paroxysmal nocturnal haemoglobinuria. British J Haem. 2007; 137:3, 181‑192.
-
(10) Rother et al. The Clinical Sequelae of Intravascular Hemolysis and Extracellular Plasma Hemoglobin.JAMA 2005;293:1653‑1662
-
(11) Dacie JV et al. Paroxysmal Nocturnal Hemoglobinuria: Clinical Manifestations, Haematology, and Nature of the Disease. Ser Haematol 1972;5:3‑23
-
(12) Hillmen P et al. The Complement Inhibitor Eculizumab in Paroxysmal Nocturnal Hemoglobinuria. N Engl J Med 2006;355:1233‑1243
-
(13) Brodsky et al. Multicenter Phase 3 study of the complement inhibitor eculizumab for the treatment of patients with paroxysmal nocturnal hemoglobinuria. Blood 2008;111:1840‑1847
-
(14) Schubert J et cl. Eculizumab, a terminal complement inhibitor, improves anaemia in patients with paroxysmal nocturnal haemoglobinuria. Br J Haematol 2008:142 (2) :263‑272
-
(15) Hillmen P et al. Effect of the complement inhibitor eculizumab an thromboembolism in patients with PNH. Blood 2007;1 10:4123‑4128
Quelle: Pressekonferenz der Firma Alexion zum Thema „Diagnostik und Therapie der hämatopoetischen Insuffizienz“ am 19.06.2009 in Duisburg (CGC-Cramer Gesundheits Consulting).