MEDIZIN
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
10 Jahre Humira® (Adalimumab)
Durch Innovation zur verbesserten Therapie
Stationen einer Erfolgsgeschichte
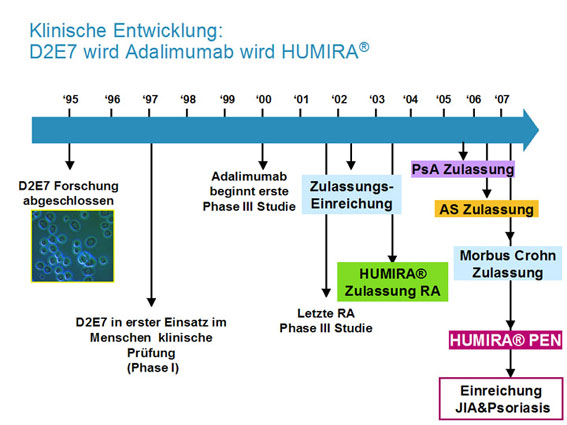
Hamburg (20. September 2007) – 1997 war ein besonderes Jahr für die Forschung mit therapeutischen Antikörpern. Damals begann das 2001 von Abbott übernommene BASF-Tochterunternehmen Knoll seine Pilotstudie mit dem weltweit ersten vollständig humanen Antikörper D2E7 (Adalimumab) bei Patienten mit rheumatoider Arthritis (RA). Ihre viel versprechenden Ergebnisse waren der Beginn der Erfolgsgeschichte von Humira®, die bis heute andauert. Nach erfolgreichem Abschluss der letzten Phase-III-Studie im Jahre 2001 erhielt Adalimumab 2003 die Zulassung zur Behandlung der RA. In den Jahren 2005 und 2006 wurden Zulassungen für die Indikationen Psoriasis-Arthritis und Morbus Bechterew, zwei weiteren Autoimmunerkrankungen, erteilt. Seit Juni 2007 steht der TNF-a-Inhibitor darüber hinaus zur Therapie des Morbus Crohn zur Verfügung. Damit ist das Potential von Adalimumab aber noch nicht ausgeschöpft: Zulassungsanträge für den TNF-a-Inhibitor in den Indikationen Psoriasis und juvenile idiopathische Arthritis sind bereits gestellt, die Zulassungen werden Ende 2007/Anfang 2008 erwartet. Die Sicherheit und Wirksamkeit von Humira wurden im Rahmen von über zehn Studien zu den verschiedenen Erkrankungen an nahezu 5.300 Patienten belegt.
Heute werden weltweit ca. 190.000 Patienten und in Deutschland rund 14.000 Betroffene mit Adalimumab behandelt, eine Zahl, die künftig noch deutlich ansteigen dürfte. Zum Erfolg des Medikaments hat maßgeblich sein innovativer Entwicklungs- und Wirkansatz beigetragen, der den Antikörper zu einem Vorreiter in punkto Verträglichkeit werden ließ. Adalimumab ist darüber hinaus der einzige TNF-a-Inhibitor in Deutschland, der von den Patienten mittels eines PENs selbst appliziert werden kann.
Zielgerichtete Therapie durch TNF-a-Inhibitoren
TNF-a-Inhibitoren wie die Antikörper Adalimumab und Infliximab und das Rezeptorkonstrukt Etanercept wurden mit dem Ziel entwickelt, die Funktion des Zytokins Tumor-Nekrose-Faktor-alpha (TNF-a) gezielt zu blockieren. Die Überproduktion dieses Botenstoffs spielt eine zentrale Rolle bei einer Reihe von Autoimmunerkrankungen. TNF-a wird von bestimmten Abwehrzellen ausgeschüttet und verstärkt die Entzündungsreaktionen, indem es andere Immunzellen aktiviert, die zusätzliche Botenstoffe wie Interleukin 1, 6, oder 8 ausschütten. Um seine Aufgabe erfüllen zu können, muss TNF-a zunächst an bestimmte Bindungsstellen (Rezeptoren) dieser Immunzellen „andocken“, was durch TNF-a-Inhibitoren verhindert wird. Sie binden freien TNF, der sich hierdurch nicht mehr an seine Rezeptoren anlagern kann, und bewirken so ein Erliegen der Entzündung. Darüber hinaus wird TNF-a durch Bindung an Adalimumab “markiert”, d.h., es wird für andere Teile des Immunsystsems als „schädlich“ gemeldet und abgebaut. TNF-a-Inhibitoren bilden somit eine hochwirksame Behandlungsmöglichkeit für Patienten, die auf herkömmliche, weniger zielgerichtete Therapieoptionen nicht oder nur unzureichend ansprechen oder sie nicht vertragen.

Von Mäusen, Menschen und Viren
Adalimumab zeichnet sich vor allem dadurch aus, dass es als einziger TNF-a-Antikörper vollständig aus menschlichen Proteinsequenzen besteht. Damit unterscheidet es sich deutlich von früheren Entwicklungen wie Infliximab. Dieser so genannte chimäre Antikörper besteht noch zu 25 Prozent aus Eiweißketten der Maus, die vom menschlichen Immunsystem als „fremd“ erkannt und daher rasch abgebaut werden. Darüber hinaus führen die gegen die Maussequenzen gebildeten Antikörper nicht selten zu allergischen und/oder anaphylaktischen Reaktionen.
Um dies zu umgehen, setzte man bei der Entwicklung von Adalimumab die Phagen-Display-Technik ein. Dieses Projekt wurde durch eine Kooperation von Abbott und Cambridge Antibody Technology (CAT) erfolgreich durchgeführt. Zunächst wurden von einer Vielzahl menschlicher Spender die Gene für die leichten und die schweren Proteinketten der Antikörper isoliert, miteinander vermischt und enzymatisch zusammmen gefügt. Hieraus ergaben sich Genkombinationen für Millionen verschiedener Antikörper, von denen einige potenziell an TNF-a binden sollten. Um entsprechende Kandidaten zu identifizieren, wurden die Genkombinationen in das Erbgut von Viren (Bakteriophagen) eingefügt und zwar in die DNA-Sequenzen, die für die Hüllproteine des Phagen kodieren. Sobald die Viren neue Hüllen bildeten, präsentierten sie auch die Antikörpersequenzen auf ihrer Oberfläche. Mittels Chromatographie konnten nun solche Viren identifiziert werden, deren Antikörperketten hochspezifisch an TNF-a in der Säulenmatrix binden. Aus diesen wurde die menschliche Erbinformation wieder isoliert und in Säugerzellen übertragen. Die hierfür verwendeten Ovarialzellen aus chinesischen Hamstern (Chinese Hamster Ovary, CHO) setzten sie wieder in Antikörper um, die den Antikörpern im menschlichen Organismus in jeder Hinsicht entsprechen. Durch Kultivierung der CHO-Zellen in großem Maßstab konnten nun ausreichende Mengen des Antikörpers gewonnen werden, die nach entsprechender Aufreinigung zum Einsatz kommen konnten.
Da Adalimumab vollständig aus menschlichen Proteinsequenzen besteht, ist die Bildung von körpereigenen Antikörpern gegen diesen TNF-a-Inhibitor stark reduziert. Im Gegensatz dazu bilden sich unter chimären Antikörpern deutlich mehr körpereigene Antikörper. Daher kann unter Adalimumab das Risiko für das Auftreten allergischer/anaphylaktischer Reaktionen sinken. Darüber hinaus wird Adalimumab deutlich langsamer abgebaut als Infliximab. Letzteres bewirkt eine Halbwertszeit von neun Tagen, gegenüber 14 Tagen bei Adalimumab. Obwohl ebenfalls komplett aus menschlichen Proteinsequenzen bestehend, besitzt auch der TNF-a-Inhibitor Etanercept nur eine Halbwertszeit von knapp drei Tagen. Bei Etanercept handelt es sich jedoch nicht um einen Antikörper, sondern um ein künstlich hergestelltes TNF-a-Rezeptorkonstrukt, das in dieser Form im Körper nicht vorkommt.
Einfache Anwendung durch patientenfreundlichen PEN
TNF-a-Inhibitoren sind sehr empfindliche Eiweiße, die parenteral appliziert werden müssen. Während Infliximab alle sechs bis acht Wochen intravenös infundiert wird, kann sich der Patient Etanercept zwei Mal pro Woche selbst subkutan injizieren. Bei Adalimumab beträgt der Zeitraum zwischen zwei Selbstapplikationen 14 Tage. Hierzu können speziell auf die Bedürfnisse von Patienten mit RA abgestimmte Spritzen benutzt werden, die durch besondere Halteflügel auch bei Verformungen der Hände eine einfache Anwendung gewährleisten. Noch patientenfreundlicher ist der Gebrauch des seit Juni 2007 auch in Deutschland erhältlichen Injektions-PENs. Adalimumab ist der bisher einzige TNF-a-Inhibitor in Deutschland, der diese Applikationsmöglichkeit bietet.
Quelle: Pressekonferenz der Firma Abbott Immunology im Rahmen des 35. Kongresses der Deutschen Gesellschaft für Rheumatologie (DGRh) zum Thema „10 Jahre Adalimumab: von D2E7 zu Remission-plus“ am 20.09.07 in Hamburg (Weber Shandwick).