MEDIZIN
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Jahrestagung der Deutschen, Österreichischen und Schweizer Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO) 2017: Die Bedeutung von Ponatinib (Iclusig®*) in der Therapie der Philadelphia-Chromosom-positiven akuten lymphatischen Leukämie (Ph+
Martinsried (6. Oktober 2017) – Für Patienten mit Ph+ ALL gilt die Behandlung mit einem Tyrosinkinaseinhibitor (TKI), kombiniert mit einer Chemotherapie, als Standard in der Erstlinientherapie. Doch Rezidive sind weiterhin ein großes Problem in der Therapie der Ph+ ALL, oftmals vermittelt durch Resistenzen, hier insbesondere durch die T315I-Mutation der BCR-ABL-Kinase. Ponatinib, ein TKI der dritten
WEITERLESEN »
Update zu den Therapieempfehlungen: Einsatz von Ponatinib (Iclusig®) in der täglichen Praxis
Frankfurt am Main ( 31. Mai 2017 ) – Die 4-Jahres-Daten aus der zulassungsrelevanten PACE Studie zu Ponatinib [1] wie auch die neuesten Auswertungen der PACE-Studie (5-Jahres-Daten), die auf dem ASCO Annual Meeting 2017 in Chicago vorgestellt werden [2], bestätigen, dass bei der Mehrheit der Patienten mit chronischer myeloischer Leukämie (CML) das Ansprechen unter einer
WEITERLESEN »
Jahrestagung der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie 2016: Die Rolle der TKI-Therapie in der Ph+ ALL unter besonderer Berücksichtigung von Ponatinib (Iclusig®)
Leipzig (15. Oktober 2016) – Durch den Einsatz von Tyrosinkinaseinhibitoren (TKI) haben sich die Überlebensraten von Patienten mit Philadelphia-Chromosom-positiver akuter lymphatischer Leukämie (Ph+ ALL) in den vergangenen Jahren von 20% auf heute über 50% deutlich verbessert [1]. Mit der Zulassung von Ponatinib (Iclusig®) steht in der Therapie erwachsener Ph+ ALL-Patienten in späteren Therapielinien ein weiterer
WEITERLESEN »
Rote-Hand-Brief zu Zydelig® (Idelalisib): Aktualisierte Empfehlungen nach Abschluss der Überprüfung der Sicherheitsdaten
Bonn (23. August 2016) – Die Firma Gilead Sciences GmbH informiert über das aktualisierte Anwendungsgebiet von Idelalisib als Erstlinientherapie von Patienten mit chronischer lymphatischer Leukämie (CLL) und Maßnahmen zur Risikominimierung zur Vorbeugung von Infektionen.
Idelalisib in der Zweitlinientherapie bei CLL: Zusatznutzen erneut nicht belegt
Zulassungsänderung wegen Komplikationen Köln (1. Juli 2016) – Bereits 2014 hat das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) in einer frühen Nutzenbewertung untersucht, ob Idelalisib bestimmten Patientinnen und Patienten mit chronischer lymphatischer Leukämie (CLL) Vorteile gegenüber der zweckmäßigen Vergleichstherapie bietet. Ein Zusatznutzen war demnach nicht belegt, da der Hersteller keine geeigneten Daten vorgelegt
WEITERLESEN »
Deutscher Krebskongress 2016: Ponatinib (Iclusig®) in der Drittlinie bei CP-CMLPatienten besonders wirksam – Neue Analysen aus der PACE-Studie
Berlin (26. Februar 2016) – Auf dem diesjährigen Deutschen Krebskongress in Berlin wurden aktuelle auf der Jahrestagung der American Society of Hematology (ASH) vorgestellte Daten zu Ponatinib (Iclusig®) diskutiert. Die Auswertungen der PACE-Studie von Levy et al. und Hochhaus et al. [1,2] zeigen, dass es bei CML-Patienten in der chronischen Phase (CP-CML) mit Intoleranz oder
WEITERLESEN »
Amgen stellt auf dem ASH-Kongress 2015 neue Studiendaten zu Blincyto® (Blinatumomab) bei akuter lymphatischer Leukämie vor: Positive Ergebnisse bei schwer therapierbaren Patienten-Untergruppen
MÜNCHEN (17. Dezember 2015) – Amgen (NASDAQ:AMGN) gibt im Rahmen der 57. Jahrestagung der American Society of Hematology (ASH) in Orlando (Florida, USA) bekannt, dass neue Studiendaten aus drei Phase II-Studien die Wirksamkeit und Sicherheit von BLINCYTO® (Blinatumomab) zur Behandlung von Erwachsenen mit akuter lymphatischer Leukämie (ALL) bestätigen.
ARIAD präsentiert neue Langzeit-Daten zur Sicherheit und Wirksamkeit von Ponatinib (Iclusig®) bei CP-CML-Patienten aus der klinischen Phase-II-Studie „PACE“
München (2. Juli 2015) – ARIAD Pharmaceuticals Inc. hat Nachbeobachtungsdaten aus der zulassungsrelevanten Phase-II-Studie „PACE“ zu Ponatinib (Iclusig®), dem zugelassenen BCR-ABL-Inhibitor, erhoben. Die Daten wurden jetzt im Rahmen der 20. Jahrestagung der Europäischen Gesellschaft für Hämatologie (EHA) in Wien vorgestellt. Inkludiert waren stark vorbehandelte Patienten mit behandlungsresistenter oder -intoleranter chronischer myeloischer Leukämie (CML) oder
WEITERLESEN »
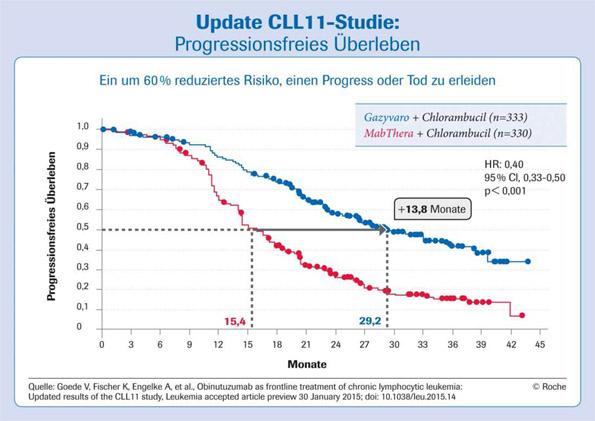
Typische CLL-Patienten: Progressionsfreies Überleben mit Gazyvaro (Obinutuzumab) nahezu verdoppelt
Hamburg (24. Juni 2015) – In der Zulassungsstudie CLL11 hatte der Typ-II-Anti-CD20-Antikörper Gazyvaro® (Obinutuzumab) in Kombination mit Chlorambucil seine deutliche Überlegenheit gegenüber der Chemoimmuntherapie mit dem bisherigen Therapiestandard Mab-Thera® (Rituximab) und auch der Chlorambucil-Monotherapie bewiesen.1 Ein Update der von Roche in Zusammenarbeit mit der Deutschen CLL-Studiengruppe (DCLLSG) durchgeführten Studie zeigt nun nochmals eine Verbesserung des
WEITERLESEN »
ASH 2014: Chronisch myeloische Leukämie (CML) – Ponatinib bewirkt in der Drittlinie wahrscheinlich höchste Ansprechraten
Frankfurt am Main (23. Februar 2015) – Ponatinib ist ein Tyrosinkinase-Inhibitor (TKI) der dritten Generation, der seit 2013 das Armamentarium in der Behandlung der chronisch myeloischen Leukämie (CML) bereichert. Beim Annual Meeting der American Society of Hematology (ASH) 2014 in San Francisco wurden Langzeitergebnisse zu Sicherheit und Wirksamkeit von Ponatinib vorgestellt und eine Einordnung in
WEITERLESEN »
ASH 2014: Neuer Therapiestandard und Behandlungsperspektiven für Patienten mit chronischer lymphatischer Leukämie
Frankfurt am Main (14. Januar 2015) – In der Behandlung von Patienten mit chronischer lymphatischer Leukämie (CLL) werden aktuell kontinuierlich Fortschritte erzielt. So steht für typische CLL-Erstlinien-Patienten mit GazyvaroTM (Obinutuzumab) in Kombination mit Chlorambucil ein neuer Therapiestandard zur Verfügung, der bei über einem Drittel der in der CLL11-Studie behandelten Patienten einen negativen Status der minimalen
WEITERLESEN »
Chronisch Lymphatischen Leukämie (CLL): Zusatznutzen von Idelalisib ist nicht belegt
Dossier enthält weder für CLL noch für follikuläres Lymphom geeignete Daten Köln (2. Januar 2015) – Idelalisib (Handelsname Zydelig) steht seit September 2014 Patientinnen und Patienten mit einem follikulären Lymphom oder einer Chronisch Lymphatischen Leukämie (CLL) zur Verfügung. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) hat in einer Dossierbewertung überprüft, ob dieser Wirkstoff
WEITERLESEN »
Ibrutinib: erster oraler Bruton-Tyrosinkinase-Inhibitor zur Therapie von CLL und MCL
Frankfurt am Main (21. November 2014) – Ibrutinib (Imbruvica®) von Janssen ist der erste Bruton-Tyrosinkinase-Inhibitor. Mit seinem neuartigen Wirkprinzip stellt er eine wichtige Therapieoption für erwachsene Patienten mit Chronischer Lymphatischer Leukämie (CLL) oder mit Mantelzell-Lymphom (MCL) dar. Der Inhibitor richtet sich gegen die Bruton-Tyrosinkinase (BTK), einem Bestandteil des B-Zell-Rezeptor-Signalweges, der bei CLL und MCL pathologisch
WEITERLESEN »
Durchbruch in der CLL-Therapie: EU-Zulassung für Gazyvaro* (Obinutuzumab)
Grenzach-Wyhlen (15. September 2014) – Die europäische Zulassungsbehörde EMA (European Medicines Agency) hat den monoklonalen Anti-CD20-Antikörper GazyvaroTM (Obinutuzumab) zur Erstlinientherapie der chronischen lymphatischen Leukämie (CLL) bei typischen Patienten mit Begleiterkrankungen zugelassen. Gazyvaro ist ein neuer Typ-II-Antikörper, der von Roche in der Phase-III-Studie CLL11 in Zusammenarbeit mit der Deutschen CLL-Studiengruppe (DCLLSG) geprüft wurde. In Kombination mit
WEITERLESEN »
Positives CHMP-Votum für GA101: Zulassungsempfehlung bei CLL-Patienten mit Begleiterkrankungen
Grenzach-Wyhlen (23. Juni 2014) – Der neue Typ-II-Anti-CD20-Antikörper GA101 (Gazyvaro, Obinutuzumab) hat vom Ausschuss für Humanarzneimittel (CHMP) der europäischen Arzneimittelagentur EMA die Empfehlung zur EU-weiten Zulassung erhalten. Diese gilt für die Erstlinientherapie von älteren Patienten mit chronisch-lymphatischer Leukämie (CLL) und Begleiterkrankungen – die typischen CLL-Patienten im klinischen Alltag. Grundlage des positiven Votums sind die Ergebnisse
WEITERLESEN »
ICLUSIG® erweitert die Therapieoptionen der Chronischen Myeloischen Leukämie und der Philadelphia-Chromosom positiven akuten lymphatischen Leukämie
Berlin (21. Februar 2014) – In die Zulassungsstudie wurden Patienten mit chronischer myeloischer Leukämie (CML) und Philadelphia-Chromosom positiver akuter lymphatischer Leukämie (Ph+ALL) eingeschlossen, bei denen entweder eine T315I-Mutation vorlag oder die resistent bzw. intolerant gegenüber Dasatinib oder Nilotinib* waren. Im Falle der Unverträglichkeit gegenüber den genannten Tyrosinkinase-inhibitoren durfte eine nachfolgende Therapie mit Imatinib keine
WEITERLESEN »
Neuer Typ-II-Antikörper GA101 erzielt eindrucksvollen Therapieerfolg bei typischen CLL-Patienten
Grenzach-Wyhlen (15. Januar 2014) – Mit GA101 (Obinutuzumab) erreicht erstmals ein neuer Typ-II-Anti-CD20-Antikörper eine signifikante Überlegenheit gegenüber MabThera (Rituximab). In der multizentrischen Phase III-Studie CLL11 führte die Gabe von GA101 in Kombination mit Chlorambucil in der Erstlinientherapie bei typischen, d. h. älteren und komorbiden Patienten mit chronisch-lymphatischer Leukämie (CLL), zu einem um 61% reduzierten
WEITERLESEN »
Rote-Hand-Brief zu Iclusig® (Ponatinib): Risiko für das Auftreten von Gefäßverschlüssen
Berlin (2. Dezember 2013) – Ponatinib ist ein Proteinkinase-Inhibitor und wird in bestimmten Situationen angewendet bei erwachsenen Patienten mit chronischer myeloischer Leukämie (CML) oder Philadelphia-Chromosom-positiver akuter Lymphoblastenleukämie (Ph+ ALL) (nähere Angaben zur Indikation siehe Fachinformation).
Roche-Medikament Gazyva verzögert bei Patienten mit einer der häufigsten Formen von Blutkrebs das Fortschreiten der Erkrankung signifikant länger als MabThera/Rituxan
Zweite Stufe der Phase-III-Studie CLL11 zeigte, dass Gazyva plus Chlorambucil bei Patienten mit nicht vorbehandelter chronischer lymphatischer Leukämie das Risiko für das Fortschreiten der Erkrankung oder den Tod um 61 % reduzierte verglichen mit MabThera/Rituxan plus Chlorambucil Neue Daten aus Teil 1a der CLL11-Studie zeigen, dass Gazyva plus Chlorambucil im Vergleich zu Chlorambucil allein
WEITERLESEN »
FDA erteilt Zulassung für Gazyva von Roche (obinutuzumab) zur Therapie von Patienten mit nicht vorbehandelter chronischer lymphatischer Leukämie (CLL)
Gazyva in Kombination mit Chemotherapie zeigte eine 84-prozentige Reduktion des Risikos für ein Fortschreiten der Erkrankung oder den Eintritt des Todes, verglichen mit Chemotherapie allein Gazyva ist das erste Medikament, das mit dem Status eines Therapiedurchbruchs (Breakthrough Therapy Designation) von der FDA zugelassen wurde Grenzach-Wyhlen (1. November 2013) – Roche gab heute bekannt, dass die
WEITERLESEN »
ASCO 2013: Antikörper GA101 und MabThera verbessern progressionsfreie Überlebenszeit von CLL-Patienten
Grenzach-Wyhlen (12. Juni 2013) – Bei der Jahrestagung der American Society of Clinical Oncology (ASCO) in Chicago wurden erstmals die vielversprechenden Resultate der Phase-III-Studie CLL11 präsentiert. Der neue, im Glycoengineering-Verfahren hergestellte monoklonale Typ-II-Anti-CD20-Antikörper Obinutuzumab (GA101) wurde in der Erstlinientherapie bei komorbiden Patienten mit chronisch-lymphatischer Leukämie (CLL) untersucht, der häufigsten Leukämie bei Erwachsenen in der westlichen
WEITERLESEN »
Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) und Deutsche Gesellschaft für Hämatologie und Onkologie (DGHO): Krebsmedikament für Leukämie nicht lieferbar!
Berlin (3. September 2012) – Die Firma Pfizer hat angekündigt an, dass sie „Anfang September einen vorübergehenden Lieferengpass bei Daunoblastin®“ erwartet. Daunoblastin® (Daunorubicin) ist ein seit 40 Jahren angewendetes, hochwirksames und nicht verzichtbares Medikament für die Behandlung von Patienten mit akuter Leukämie bei Erwachsenen und Kindern. Die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) und die
WEITERLESEN »
DGHO: Versorgung der Bevölkerung mit essenziellen Krebsmedikamenten
Berlin (22. August 2012) – Am 14. August 2012 meldete die Europäische Zulassungsbehörde EMA, dass Genzyme, eine Tochterfirma von Sanofi-Aventis, das Krebsmittel Alemtuzumab aus kommerziellen Gründen vom Markt nimmt. Der monoklonale Antikörper Alemtuzumab (Mabcampath®) ist eines der wirksamsten Medikamente für Patienten mit chronischer lymphatischer Leukämie (CLL), der häufigsten Leukämieform in Deutschland. Alemtuzumab gehört zum
WEITERLESEN »
Akute myeloische Leukämie: Decitabin erhält Zulassungsempfehlung des CHMP
Neuss (25. Juli 2012) Janssen-Cilag International NV gab bekannt, dass der Ausschuss für Humanarzneimittel (Committee for Medical Products for Human Use, CHMP) der Europäischen Arzneimittelagentur, EMA, eine positive Zulassungsempfehlung für die Anwendung des hypomethylierenden Wirkstoffs Decitabin bei der akuten myeloischen Leukämie erteilt hat. Die vom CHMP empfohlene Indikation lautet: Decitabin ist indiziert zur Behandlung
WEITERLESEN »
Bendamustin ist ein fest etabliertes Basistherapeutikum für Patienten mit chronischer lymphatischer Leukämie
Berlin (25. Februar 2012) – Die chronische lymphatische Leukämie (CLL) ist eine in der Regel unheilbare Erkrankung des höheren Lebensalters. Der einzige kurative Ansatz besteht in einer Knochenmarktransplantation, die jedoch nur für wenige Patienten indiziert ist. Bei der Mehrzahl der Patienten ist das angestrebte Therapieziel die Symptomlinderung und -kontrolle durch eine Chemotherapie.
Ceplene®: Neue Kombination als Therapieoption bei AML
Berlin (1. Oktober 2010) – Mit Histamindihydrochlorid (Ceplene® Injektionslösung, MEDA Pharma, EpiCept) gibt es seit Mai 2010 das erste zugelassene Medikament zur Erhaltungstherapie bei erwachsenen Patienten mit akuter myeloischer Leukämie (AML). Zum Einsatz kommt der Wirkstoff in Kombination mit Interleukin-2 (IL-2) während der ersten Remission. Empfohlen wird eine Dosis von zweimal täglich 0,5 mg
WEITERLESEN »
Neue gezielte Therapie für spezielle Form der Leukämie
Patienten mit akuter myeloischer Leukämie haben Grund zur Hoffnung Teilnehmer für multinationale, individualisierte Studie gesucht Heidelberg (1. Juni 2010) – Ein neuer Wirkstoff (AC220) verspricht eine deutlich verbesserte Therapie für Patienten mit akuter myeloischer Leukämie (AML). Erste klinische Studien wurden an Patienten mit einem AML-Rückfall und einer speziellen Genveränderung, der FLT3-ITD-Mutation, durchgeführt. Die
WEITERLESEN »
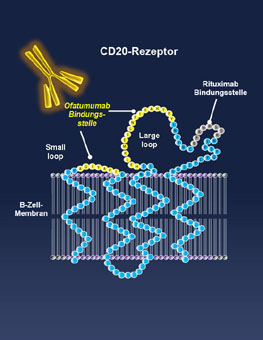
Ofatumumab: Viel versprechende Ergebnisse bei chronischer lymphatischer Leukämie
Neuer monoklonaler CD20-Antikörper mit hohen Ansprech-raten CHMP empfiehlt Zulassung für Patienten mit refraktärer CLL Berlin (25. Februar 2010) – Der von den Unternehmen GlaxoSmithKline und Genmab gemeinsam entwickelte monoklonale CD20-Antikörper Ofatumumab (geplanter Handelsname Arzerra®) erwies sich bei Patienten mit stark vorbehandelter, refraktärer chronischer lymphatischer Leukämie (CLL) als erstaunlich wirksam. Der Ausschuss für Humanarzneimittel der
WEITERLESEN »
Weniger ist mehr: Marburger Krebsforscher erproben neue Leukämie-Behandlung
Marburg (10. Februar 2010) – Heilungserfolge bei Leukämie lassen sich verstetigen, wenn ein neues Therapiekonzept zum Einsatz kommt, das Resistenzen gegen Krebsmedikamente verhindert. Krebsforscher aus Marburg, Mannheim und Jena schildern das von ihnen getestete Verfahren vorab in der aktuellen Online-Ausgabe des Fachblatts "Journal of Clinical Oncology": Die Mediziner verabreichten zunächst das Standardmedikament Imatinib in
WEITERLESEN »
MabThera® bei CLL-Patienten: Erstmals Überlebensvorteil in randomisierter Studie gezeigt
Köln (14. Januar 2010) – Eines der meist beachteten Highlights der diesjährigen 51. Jahrestagung der American Society of Hematology (ASH) in New Orleans/LA, USA, waren die aktualisierten Follow up-Daten der offenen, multizentrischen und randomisierten Phase III-Studie CLL8 der Deutschen CLL-Studiengruppe (DCLLSG). Mit über 800 Patienten ist diese Untersuchung eine der bisher größten weltweit durchgeführten
WEITERLESEN »
Tasigna® zeigt signifikant bessere Therapieergebnisse als der Standard Glivec® bei Patienten mit neu diagnostizierter chronischer myeloischer Leukämie (CML) in der chronischen Phase
Tasigna in allen relevanten Studien-Parametern überlegen: nach 12 Monaten signifikant höhere Rate an guter molekularer Remission (MMR) (1) Nach 12 Monaten zeigten signifikant weniger Patienten ein Fortschreiten der Erkrankung in die akzelerierte Phase oder Blastenkrise Tasigna erneut als sichere Therapie bei Patienten mit neu diagnostizierter Ph+ CML bestätigt; insbesondere bei Dosierung 300 mg BID
WEITERLESEN »
Jan Geißler: Thema „Therapietreue“ (Compliance) bei CML
Jan Geißler, CML‑Patient und 1. Vorsitzender Leukämie‑Online e.V. Mannheim (4. Oktober 2009) – Eine eigentlich von ihrer Natur her sehr aggressive Krebserkrankung, die Chronische Myeloische Leukämie (CML), ist glücklicherweise durch therapeutische Innovationen für einen Großteil der Patienten zu einer chronischen Erkrankung geworden. Anders als noch vor 8 Jahren erlaubt diese mit meist geringen
WEITERLESEN »
Chronisch-lymphatische Leukämie (CLL)
Köln (17. September 2009) – Die internationale REACH-Studie ist mit 552 rezidivierten oder refraktären CLL-Patienten die größte randomisierte multinationale Untersuchung bei diesem Patientenkollektiv und führte zur europäischen Zulassung von Rituximab (MabThera®) in Kombination mit einer Chemotherapie im September 2009. Die signifikante Überlegenheit der Dreifachkombination Fludarabin/Cyclophosphamid plus Rituximab (FCR) in der Rezidivtherapie zeigte sich in
WEITERLESEN »
Sorafenib: Hilfe gegen Leukämie
Marburg (10. Juli 2009) – Hoffnung für Leukämiepatienten: Marburger Onkologen haben nachgewiesen, dass ein Medikament gegen Leber- und Nierenkrebs auch bei einer bestimmten Form von Blutkrebs hilft, nämlich bei akuter myeloischer Leukämie (AML). Die Mediziner haben ihre Ergebnisse in der Fachzeitschrift "Blood" veröffentlicht. Aufgrund dieser Daten hat die US-amerikanische Aufsichtsbehörde für Arzneimittel FDA angekündigt,
WEITERLESEN »
MabThera® erhält in Europa positive Empfehlung für Erstbehandlung der chronisch-lymphatischen Leukämie (CLL)
Wichtiger Schritt zur Zulassungserweiterung für MabThera in Kombination mit Chemotherapie Grenzach-Wyhlen (23. Januar 2009) – Roche hat heute bekannt gegeben, dass der EU-Ausschuss für Humanarzneimittel (CHMP) eine positive Stellungnahme zu MabThera (Rituximab) abgegeben hat. Die Empfehlung bezieht sich auf MabThera in Kombination mit jeder beliebigen Chemotherapie als Erstbehandlung der chronisch-lymphatischen Leukämie (CLL), der häufigsten Leukämieform
WEITERLESEN »
Glivec® (Imatinib) zeigt bisher unerreichte Überlebenszeiten bei CML-Patienten der IRIS-Studie. Tasigna® (Nilotinib) als effektive Zweitlinientherapie bestätigt
Glivec: Eine Überlebensrate von 86 % nach sieben Jahren ist bisher in der CML-Therapie unerreicht Tasigna: Positive Studienresultate belegen hohe Wirksamkeit bei CML-Patienten 26 Präsentationen, 76 Poster und 105 Abstracts auf dem weltweit wichtigsten Hämatologie-Kongress belegen die führende Rolle von Glivec und Tasigna in der Behandlung von Patienten mit CML Frankfurt am Main
WEITERLESEN »
Dr. Barbara Eichhorst: Längeres krankheitsfreies Überleben bei der CLL
Von Dr. Barbara Eichhorst Köln (15. Januar 2009) – Seit Einführung der Substanz Chlorambucil zur Behandlung der CLL in den 50er Jahren stand die Symptomkontrolle und Stabilisierung der Erkrankung im Vordergrund. Mit Chlorambucil wurden nur sehr kurze Zeiten eines krankheitsfreien Überlebens erreicht. Dies änderte sich erstmals mit der Einführung der Purinanaloga Fludarabin und
WEITERLESEN »
REACH-Studie: Neuer Therapiebaustein bei der chronisch-lymphatischen Leukämie
Köln (15. Januar 2009) – Die Ergebnisse der REACH-Studie wurden auf der 50. Jahrestagung der American Society of Hematology (ASH) als wichtiger Fortschritt für rezidivierte und refraktäre Patienten mit chronisch-lymphatischer Leukämie (CLL) gewürdigt: Mit dem Dreifachregime Fludarabin/ Cyclophosphamid plus Rituximab (MabThera®) haben die Patienten eine doppelt so hohe Chance auf ein komplettes Ansprechen wie
WEITERLESEN »
Neues vom ASH: Neuer Therapiestandard bei chronisch-lymphatischer Leukämie (CLL)
CLL8-Studie: Erstlinientherapie mit Rituximab verlängert progressionsfreies Überleben Köln (15. Januar 2009) – Die CLL8-Studie der deutschen CLL-Studiengruppe definiert einen neuen Standard für die Erstlinientherapie der chronisch-lymphatischen Leukämie (CLL): Nicht vorbehandelte CLL-Patienten profitieren von Rituximab (MabThera®) zusätzlich zur Chemotherapie mit einer Verdopplung der kompletten Remissionsrate und einer Verlängerung des progressionsfreien Überlebens um 10 Monate im Vergleich
WEITERLESEN »
Europäische Zulassung für MabThera zur Behandlung der häufigsten Leukämieart bei Erwachsenen erwartet
Grenzach-Wyhlen (7. August 2008) – Der Antrag basiert auf einer Phase-III-Studie, welche die Überlegenheit von MabThera in Kombination mit einer Standard-Chemotherapie bei der Behandlung der Chronisch-lymphatischen Leukämie (CLL) bestätigt. Roche hat die „Marketing Authorisation Application" (MAA) bei der Europäischen Arzneimittelbehörde (EMEA) für den Einsatz des monoklonalen Antikörpers MabThera (Rituximab) in der Erstlinienbehandlung der Chronischen
WEITERLESEN »
Kooperationsprojekt zwischen dem European LeukemiaNet und der Novartis AG seit einem Jahr erfolgreich
Heidelberg (11. Juli 2008) – Die Zusammenarbeit zwischen dem European LeukemiaNet (ELN) und dem Unternehmen Novartis blickt auf ein erfolgreiches erstes Jahr zurück. Die unter dem Namen European Treatment and Outcome Study (EUTOS) geschlossene Kooperation hat zum Ziel, Ursachen und Verlauf der chronischen myeloischen Leukämie (CML) besser zu verstehen und die Therapiebedingungen der Patienten
WEITERLESEN »
Neue DLH-Broschüre für Patienten nach Stammzelltransplantation
Bonn (3. Juni 2008) – In Deutschland werden jährlich ca. 2000 Transplantationen mit Stammzellen von einem Familien- oder Fremdspender durchgeführt. Wenngleich die langfristige Lebensqualität der Überlebenden im Allgemeinen gut ist, handelt es sich hierbei auch heute noch um ein risikobehaftetes Therapieverfahren. Haben die Patienten die Therapie überstanden, können bestimmte Langzeitfolgen auftreten. Diesen wird durch
WEITERLESEN »
Imatinib verhindert Progression der CML in akzelerierte Phase
Nürnberg (23. Februar 2008) ‑ Neue Daten aus der größten klinischen Studie mit neu diagnostizierten Patienten mit chronischer myeloischer Leukämie (CML) haben gezeigt, dass der langfristige Einsatz von Glivec die Progression der Erkrankung in fortgeschrittene Stadien im 6. Therapiejahr aufhalten kann. Präsentiert wurden die 6‑Jahres‑Daten der IRIS-Studie (International Randomized Trial comparing Interferon alpha versus
WEITERLESEN »
Eisenchelat‑Therapie verlängert das Gesamtüberleben bei MDS‑Patienten
Erstmalig prospektiv nachgewiesen: Regelmäßige Bluttransfusionen können bei MDS-Patienten zur Eisenintoxikation führen Neue Studiendaten aus Frankreich belegen Überlebensvorteil von 64 Monaten bei MDS-Patienten unter Chelation gegenüber nicht-chelierten Patienten
Bendamustin löst Chlorambucil als Referenzsubstanz bei CLL ab
Berlin (22. Februar 2008) – Konsekutive randomisierte Studien der letzten Jahre haben systematisch die Wirksamkeit verschiedener Substanzen wie Fludarabin, Chlorambucil und Bendamustin bei Chronischer Lympathischer Leukämie (CLL) evaluiert.
Tasigna® (Nilotinib) erhält in der Europäischen Union die Zulassung für die Zweitlinientherapie von CML-Patienten
Frankfurt am Main (17. Dezember 2007) – Tasigna führte zu einem guten zytogenetischen Ansprechen bei 49 % der Patienten mit Philadelphia-Chromosom positiver chronischer myeloischer Leukämie in chronischer Phase, die eine Resistenz oder Unverträglichkeit gegenüber Glivec® (Imatinib) aufweisen. Der neue Tyrosinkinaseinhibitor von Novartis Oncology bindet noch spezifischer und stärker als Imatinib an das Bcr-Abl-Protein, die Ursache und
WEITERLESEN »