MEDIZIN
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Partner in der Hämatologie: 70 Jahre Erfahrung, Vertrauen und Engagement jetzt bei Takeda
Neue Daten bei bewährtem Faktor VIII und weiterer Meilenstein der Erfolgsgeschichte: Innovation für Patienten mit von-Willebrand-Syndrom
Berlin (27. Februar 2019) – Engagement und multiple Therapieoptionen von Shire, jetzt Teil von Takeda, in der Hämatologie – und eine enge Verbundenheit zur Hämophilie A: Das rekombinante Blutgerinnungsfaktor VIII-Präparat ADVATE® (Octocog alfa) ist seit nunmehr 15 Jahren Goldstandard in der Blutungsprophylaxe. Seit 1 Jahr steht mit ADYNOVI®▼ (Rurioctocog alfa pegol) die Halbwertszeit-verlängerte Version des bewährten Wirkstoffes zur Verfügung. Die Substitution des fehlenden Faktor VIII ist für viele Patienten die Therapie der Wahl. Den effektiven Blutungsschutz im klinischen Alltag bestätigen nun auch die neuen Ergebnisse der Langzeit Real World Evidence (RWE)-Studie AHEAD und die PROPEL- Studie mit ADYNOVI®, deren Daten auf der 63. Jahrestagung der GTH 2019 in Berlin, bzw. auf dem EHEAD Kongress in Prag, vorgestellt wurden. Ein weiteres Novum: Die Vorstellung von VEYVONDI®▼ – als erster rekombinanter von-Willebrand-Faktor und weiterer Meilenstein in der Hämatologie.
Shire, nun Teil der Takeda Group, engagiert sich als führendes Unternehmen auch weiterhin für Patienten mit seltenen und komplexen Erkrankungen, insbesondere im Bereich der Blutgerinnungsstörungen – auch in Zukunft. Der hohe Stellenwert rekombinanter Blutgerinnungsfaktoren wurde in dem Symposium ‚Gemeinsam in die Zukunft‘ auf der GTH 2019 in Berlin besonders deutlich: Getreu dem Motto ‚Ersetzen, was fehlt‘ wurde mit VEYVONDI® der erste und einzige rekombinante von-Willebrand-Faktor (VWF) für die Behandlung von Erwachsenen (> 18 Jahre) mit von-Willebrand-Syndrom (VWS), einer genetisch bedingten Erkrankung, vorgestellt. Neue Studiendaten und Praxisbeispiele zeigen außerdem die Voraussetzungen für einen effektiven Blutungsschutz bei Einsatz bewährter Faktor VIII-Präparate und der digitalen Unterstützung myPKFiT.
ADVATE®: Seit 15 Jahren der Hämophilie A verbunden
Bei Hämophilie A hat sich die Gabe rekombinanter Präparate seit Jahren bewährt, besonders die prophylaktische Anwendung von Faktor VIII (bei Faktor VIII-Talspiegeln ≥ 1%) als wirksame Maßnahme zur Vermeidung von Blutungen.1 Allen voran das Präparat ADVATE®,2 das sich seit nunmehr 15 Jahren weltweit als Goldstandard in der prophylaktischen Behandlung von Hämophilie-Patienten etabliert hat. Neue Studiendaten belegen die Effektivität und Verträglichkeit des rekombinanten Faktor VIII im Versorgungsalltag: Mit der weltweit größten Real-World Studie AHEAD wurde über einen Zeitraum von 5 Jahren, der Krankheitsverlauf von über 700 Hämophilie A-Patienten dokumentiert, darunter 376 Patienten in Deutschland.3 Unter der prophylaktischen Behandlung mit ADVATE® zeigte sich ein effektiver Blutungsschutz bei gutem Sicherheitsprofil.3 Im weiteren Verlauf der AHEAD-Studie werden jetzt auch Patienten mit ADYNOVI® eingeschlossen, so dass in den nächsten Jahren ebenfalls RWE-Daten hierfür vorliegen.
PROPEL-Studie: Effektiver Blutungsschutz bei bewährtem Faktor VIII-Wirkstoff
Dass ein effektiver Blutungsschutz auch bei einer verlängerten Halbwertszeit und entsprechend weniger Injektionen gewährleistet ist, zeigen die Ergebnisse der Studie PROPEL:4,5 Dabei wurden Sicherheit und Wirksamkeit von ADYNOVI® mit zwei unterschiedlich eingestellten Faktor VIII-Talspiegeln bei Pharmakokinetik-gesteuerter Prophylaxe verglichen. Untersucht wurden jährliche Blutungsraten bei Patienten mit schwerer Hämophilie A bei niedrigen (1-3%) und hohen (8-12%) Talspiegeln. Das Studienergebnis zeigt, dass auch mit niedrigem Talspiegel eine gute Blutungsprävention erreicht werden kann,5 vergleichbar dem Blutungsschutz in der ADYNOVI® Zulassungsstudie.6
Die Kontrolle des Talspiegels kann dabei interaktiv mit dem digitalen Tool myPKFiT erfolgen.7,8 Das CE-zertifizierte Medizinprodukt myPKFiT, welches Anfang diesen Jahres als Mobile App bei den Megaphon Awards mit Gold prämiert wurde,9 unterstützt sowohl in Kombination mit ADVATE® als auch in Kombination mit ADYNOVI® Patienten bei der interaktiven Prophylaxe und Alltagsgestaltung; behandelnde Ärzte bekommen ein wertvolles Tool für die Therapieplanung und -begleitung, wie der Referent Dr. Georg Goldmann in seinem Vortrag beschreibt.
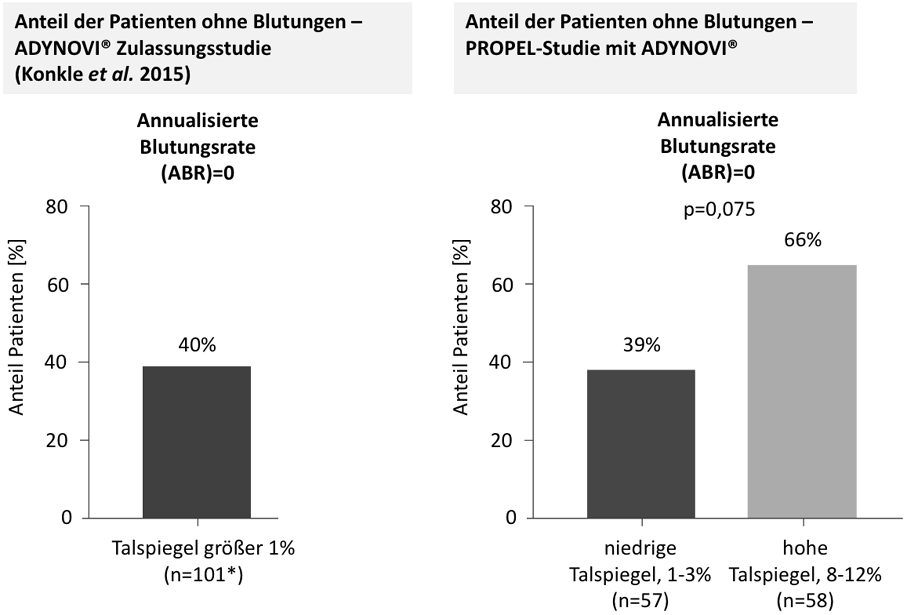
Abb.1: Anteil der Patienten ohne Blutungsereignisse (ABR) über eine Studiendauer von jeweils 6 Monaten innerhalb der ADYNOVI® Zulassungsstudie Konkle et al. 20156 und der PROPEL-Studie5 mit ADYNOVI®. *per protocol analysis set, PPAS.
Hinweis: Es handelt sich bei der gezeigten Abbildung um zwei verschiedene ADYNOVI® Studien, die nicht für den direkten Vergleich vorgesehen waren.
Neuer Meilenstein VEYVONDI®: Wie ein rekombinanter Blutgerinnungsfaktor in die Behandlung des von-Willebrand-Syndroms einzieht
VWS ist die häufigste erblich bedingte Blutgerinnungsstörung.10 Im Gegensatz zur Hämophilie, die fast ausschließlich bei Männern auftritt, sind bei dem VWS beide Geschlechter gleichermaßen betroffen. Bei Patienten mit der schweren Form des VWS kann es u.a. zu Blutungskomplikationen nach operativen Eingriffen, zu gastrointestinalen Blutungen sowie zu Einblutungen in die Gelenke kommen – mit schwerwiegenden gesundheitlichen Konsequenzen.11 Für erwachsene Patienten, die alleine auf eine Behandlung mit DDAVP nicht ansprechen oder für die es kontraindiziert ist, steht mit VEYVONDI® nun der erste rekombinant produzierte VWF zur Verfügung.12 Außerdem enthält das neue Präparat sogenannte „ultragroße Multimere“, die hinsichtlich der Stillung von Blutungen besonders effektiv sind.13,14 „Wir freuen uns sehr, dass bereits erste Patienten von der Behandlung in Deutschland profitieren“, so Dr. Dr. Ahmed Abdelmoumene, Franchise Head Hematology, Shire/Takeda.
Referenzen
- Srivastava A et al. Guidelines for the management of hemophilia. Haemophilia. 2013;19(1):e1-47.
- Fachinformation ADVATE®. Stand: Juni 2018.
- Ozelo MC, Oldenburg J, Huth-Kühne A et al. AHEAD international and German studies: Effectiveness, safety, and quality of life outcomes in hemophilia A patients treated with antihemophilic factor (recombinant) in a real world setting over 5 years. P186. Presented at the 12th Annual Congress of the European Association for Haemophilia and Allied Disorders (EAHAD); February 6–8, 2019; Prague, Czech Republic.
- Fachinformation ADYNOVI®. Stand: Februar 2018.
- Klamroth R, Windyga J, Radulescu V et al. Results From a Phase 3, Randomized, Multicenter Study of Rurioctocog Alfa Pegol PK-Guided Prophylaxis Targeting Two FVIII Trough Levels in Patients With Severe Hemophilia A (PROPEL Study). P255. Presented at the 12th Annual Congress of the European Association for Haemophilia and Allied Disorders (EAHAD); February 6–8, 2019; Prague, Czech Republic.
- Konkle BA, Stasyshyn O, Chowadary P et al. Pegylated, full-length, recombinant factor VIII for prophylactic and on-demand treatment of severe hemophilia A. Blood 2015;126(9):1078-1085.
- myPKFiT Bedienungsanleitung, VV-00960323, Shire, 2018.
- myPKFiT Mobile App v 2.0 Bedienungsanleitung, VV-00960458, Shire, 2018.
- Pressemitteilung. Shire Deutschland GmbH, jetzt Teil der Takeda Group. myPKFiT gewinnt den Econ Megaphon Award 2019. Verfügbar unter: www.shire.de/newsroom/2019/february/i6btug. Letzter Zugriff: Februar 2019.
- Skinner MW. Haemophilia. 2010;16(Suppl 5):1-10.
- Nichols WL et al. Haemophilia. 2008;14(2):171-232.
- Fachinformation VEYVONDI®. Stand: August 2018.
- The Lewin Group; Center for Comparative Effectiveness Research. Prepared for the National Hemophilia Foundation. Strategic Summit on von Willebrand disease. Vortrag am 21.11.2014. Publiziert im März 2015.
- Reininger AJ. Hämostaseologie. 2015;35(3):225-233.
Über die Shire Deutschland GmbH, jetzt Teil der Takeda Group
Takeda ist ein forschungsgetriebenes, wertebasiertes und global führendes biopharmazeutisches Unternehmen mit Hauptsitz in Japan. Als größter japanischer Arzneimittelhersteller engagiert sich Takeda in 80 Ländern und Regionen weltweit dafür, Patienten mit wegweisenden medizinischen Innovationen eine bessere Gesundheit und eine schönere Zukunft zu ermöglichen. Takeda fokussiert seine Forschung auf die Therapiegebiete Onkologie, Gastroenterologie, Erkrankungen des zentralen Nervensystems und Seltene Erkrankungen – sowohl in eigenen Zentren als auch gemeinsam mit externen Experten. Außerdem investiert Takeda zielgerichtet in Forschungsaktivitäten in den Bereichen Plasmabasierte Therapien und Impfstoffe, um eine noch stabilere und vielfältigere Pipeline aufzubauen. Dabei steht der Patient mit seinen Bedürfnissen jederzeit im Mittelpunkt: Unsere Mitarbeiter engagieren sich täglich dafür, die Lebensqualität von Patienten weltweit zu verbessern und die Zusammenarbeit mit Partnern im Gesundheitswesen voranzutreiben.
Die Shire Deutschland GmbH, seit dem 8. Januar 2019 Teil der Takeda Group, und die Takeda Pharma Vertrieb GmbH & Co. KG, ergänzt durch weitere administrative Funktionen in Konstanz, steuern von Berlin aus die gesamten Takeda Aktivitäten für den deutschen Markt. Als Teil eines globalen Produktionsnetzwerkes betreibt Takeda in Deutschland Produktionsstätten im brandenburgischen Oranienburg sowie in Singen. Insgesamt sind mehr als 2.300 Mitarbeiter für Takeda in Deutschland tätig. Besuchen Sie uns im Internet: www.shire.de und www.takeda.de; Datenschutzhinweis: www.shire.de/impressum/privacy-notice und www.takeda.de/privacy
—
ADVATE 250 I.E./ ADVATE 500 I.E./ ADVATE 1000 I.E./ ADVATE 1500 I.E./ ADVATE 2000 I.E./ ADVATE 3000 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Wirkstoff: Octocog alfa (Blutgerinnungsfaktor VIII vom Menschen (r-DNS)), hergestellt in Ovarialzellen des chinesischen Hamsters (CHO) mittels rekombinanter DNS-Technologie.
Zusammensetzung: 250/500/1000/1500/2000/3000 I.E. Octocog alfa.
Nach Rekonstitution in 2 ml Lösungsmittel enthält jede Durchstechflasche ADVATE 250 I.E./ 500 I.E./ 1000 I.E. oder 1500 I.E. ungefähr 125 I.E./ml; 250 I.E./ml; 500 I.E./ml oder 750 I.E./ml Octocog alfa.
Nach Rekonstitution in 5 ml Lösungsmittel enthält jede Durchstechflasche ADVATE 2000 I.E. bzw. ADVATE 3000 I.E. ungefähr 400 I.E./ml bzw. 600 I.E./ml Octocog alfa.
Sonstige Bestandteile: Mannitol, Natriumchlorid, Histidin, Trehalose, Calciumchlorid, Trometamol, Polysorbat 80, Glutathion (reduziert). Lösungsmittel: Wasser für Injektionszwecke.
Anwendungsgebiete: Patienten mit Hämophilie A zur Vorbeugung oder Behandlung von Spontanblutungen oder Blutungen nach chirurgischen Eingriffen.
Gegenanzeigen: Allergie gegen Octocog alfa oder einen der sonstigen Bestandteile. Allergie gegen Maus- oder Hamsterproteine.
Nebenwirkungen: Wenn plötzliche, schwere Anaphylaxien oder anaphylaktischer Schock auftreten, muss die Injektion sofort abgebrochen werden. Sehr häufig: Faktor-VIII-Inhibitoren bei zuvor nicht behandelten Kindern. Häufig: Kopfschmerzen und Fieber. Gelegentlich: Faktor VIII-Inhibitoren bei vorbehandelten Patienten, Schwindel, Grippe, Ohnmacht, anormal langsamer oder schneller Herzschlag, rote juckende Pickel auf der Haut, Beklemmungsgefühl in der Brust, Bluterguss oder Reaktion an der Injektionsstelle, Juckreiz, verstärktes Schwitzen, ungewöhnliches Geschmacksempfinden, Hitzewallungen, Migräne, Gedächtnisstörungen, Schüttelfrost, Durchfall, Übelkeit, Erbrechen, Kurzatmigkeit, rauer Hals, Entzündungen der Lymphgefäße, Blässe, Augenentzündungen, Hautausschläge, extremes Schwitzen, Anschwellen von Füßen und Beinen, Hämatokritabfall, Anstieg bestimmter weißer Blutkörperchen (Monozyten) sowie Schmerzen im Oberbauch oder unteren Brustbereich. In Verbindung mit Operationen: Katheterinfektionen, geringere Anzahl der roten Blutkörperchen, Anschwellen von Gliedmaßen und Gelenken, verlängerte Blutung nach der Entfernung einer Drainage, verminderter Faktor-VIII-Spiegel und postoperative Hämatome. In Verbindung mit zentralvenösen Kathetern: Katheterinfektionen, generalisierte Infektion (im gesamten Körper) und Blutgerinnsel am Katheter. Unbekannte Häufigkeit: Potentiell lebensbedrohliche Reaktionen (Anaphylaxie) und andere allergische Reaktionen (Überempfindlichkeitsreaktionen), allgemeine Störungen (Müdigkeit, Energielosigkeit).
Weitere Angaben: s. Fach- und Gebrauchsinformation.
Verschreibungspflichtig.
Baxter AG, Industriestraße 67, 1221 Wien, Österreich
Stand der Information: Juni 2018
—
ADYNOVI 250 I.E./ 500 I.E./ 1000 I.E./ 2000 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8 der Fachinformation.
Wirkstoff: Rurioctocog alfa pegol (pegylierter Blutgerinnungsfaktor VIII vom Menschen, hergestellt mittels rekombinanter DNA-Technologie).
Zusammensetzung: Jede Pulver-Durchstechflasche enthält 250/500/1000/2000 I.E. Rurioctocog alfa pegol Jede Pulver-Durchstechflasche mit 250/500/1000 I.E. enthält 2 ml sterilisiertes Wasser für Injektionszwecke. Jede Pulver-Durchstechflasche mit 2000 I.E. enthält 5 ml sterilisiertes Wasser für Injektionszwecke. Sonstige Bestandteile: Mannitol, Trehalosedihydrat, Histidin, Glutathion, Natriumchlorid, Calciumchloriddihydrat, Tris(hydroxymethyl)-aminomethan, Polysorbat 80.
Anwendungsgebiete: Behandlung und Vorbeugung von Blutungen bei Patienten im Alter ab 12 Jahren mit Hämophilie A (einer erblichen Blutgerinnungsstörung, die durch Mangel an Faktor VIII bedingt ist).
Gegenanzeigen: Überempfindlichkeit gegen Rurioctocog alfa pegol, Octocog alfa oder einen der genannten sonstigen Bestandteile dieses Arzneimittels. Bekannte allergische Reaktion gegen Maus- oder Hamsterprotein. •
Nebenwirkungen: Schwere, plötzliche allergische Reaktionen, (z.B. Ausschlag, Nesselausschlag, Quaddelbildung, Juckreiz am ganzen Körper, Anschwellen von Lippen und Zunge, Atembeschwerden, pfeifendes Atmen, Engegefühl in der Brust, allgemeines Unwohlsein, Schwindelgefühl und Bewusstseinsverlust). Wenn plötzliche, schwere allergische Reaktionen (Anaphylaxien) auftreten, muss die Injektion sofort abgebrochen werden. Schwere Symptome -einschließlich Atemnot und (beinah-)Ohnmacht- erfordern eine sofortige Notfallbehandlung. Häufig: Kopfschmerzen, Übelkeit, Durchfall. Gelegentlich: Hitzewallungen; Patienten mit Hämophilie A können neutralisierende Antikörper (Inhibitoren) gegen Blutgerinnungsfaktor VIII entwickeln. Wenn dies passiert, können Ihre Arzneimittel möglicherweise nicht mehr richtig wirken, und es kann zu unstillbaren Blutungen kommen. Die Nebenwirkungen bei Kindern treten in derselben Häufigkeit, Art und Schwere wie bei Erwachsenen auf.
Verschreibungspflichtig.
Pharmazeutischer Unternehmer: Baxalta Innovations GmbH, Industriestraße 67, 1221 Wien, Österreich.
Stand der Information: Februar 2018
—
VEYVONDI 650 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
VEYVONDI 1300 I.E. Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8 der Fachinformation.
Wirkstoff: Vonicog alfa, ein gereinigter rekombinanter humaner Von-Willebrand-Faktor (rVWF), hergestellt mittels rekombinanter DNA (rDNA)-Technologie in einer Ovarialzelllinie des chinesischen Hamsters (CHO).
Bestandteil mit bekannter Wirkung: Natrium.
Zusammensetzung: Jede Durchstechflasche mit Pulver enthält nominal 650 bzw. 1300 internationale Einheiten (I.E.) Vonicog alfa. Nach Rekonstitution mit 5 ml bzw. 10 ml Lösungsmittel enthält VEYVONDI ca. 130 I.E./ml Vonicog alfa.
Sonstige Bestandteile: Natriumcitrat, Glycin, Trehalosedihydrat, Mannitol, Polysorbat 80, Wasser für Injektionszwecke (Lösungsmittel).
Anwendungsgebiete: Behandlung von Blutungen und Blutungen bei Operationen, sowie Vorbeugung von Blutungen bei Operationen bei Erwachsenen (ab 18 Jahren) mit Von-Willebrand-Syndrom (VWS), wenn eine Behandlung mit Desmopressin (DDAVP) alleine nicht wirksam oder nicht indiziert ist.
Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der oben genannten sonstigen Bestandteile; bekannte allergische Reaktion gegen Maus- oder Hamsterproteine.
Nebenwirkungen: Überempfindlichkeits- oder allergische Reaktionen (einschließlich Angioödem; Brennen und Stechen an der Infusionsstelle; Schüttelfrost; Hitzegefühl; Rhinokonjunktivitis; generalisierte Urtikaria; Kopfschmerzen; Quaddeln; Hypotonie; Lethargie; Unruhe; Tachykardie; Engegefühl in der Brust; Kribbeln; Erbrechen; Giemen), die in manchen Fällen zur Anaphylaxie (einschließlich Schock) führen können; thromboembolische Ereignisse; Bildung von Inhibitoren gegen VWF; Ohnmacht; Benommenheit; Muskelzuckungen. Häufig: Hypertonie; Hitzewallung; Erbrechen; Übelkeit; Pruritus generalisiert; Brustkorbbeschwerden; Vertigo; Schwindelgefüh;, Geschmacksstörung; Tremor; Tachykardie; tiefe Venenthrombose; Parästhesie an der Infusionsstelle; Umkehr der T-Welle im Elektrokardiogramm.
Weitere Angaben: s. Fach- und Gebrauchsinformation.
Verschreibungspflichtig.
Baxalta Innovations GmbH, Industriestraße 67, 1221 Wien, Österreich
Stand der Information: August 2018
Quelle: Takeda, 27.02.2019 (tB).
Schlagwörter: Faktor VIII, Hämatologie, Takeda, von-Willebrand-Syndrom


