MEDIZIN
AWARDS
Forschergeist gefragt: 14. Novartis Oppenheim-Förderpreis für MS-Forschung ausgelobt
FernstudiumCheck Award: Deutschlands beliebteste Fernhochschule bleibt die SRH Fernhochschule
Vergabe der Wissenschaftspreise der Deutschen Hochdruckliga und der Deutschen Hypertoniestiftung
Den Patientenwillen auf der Intensivstation im Blick: Dr. Anna-Henrikje Seidlein…
Wissenschaft mit Auszeichnung: Herausragende Nachwuchsforscher auf der Jahrestagung der Deutschen…
VERANSTALTUNGEN
Wichtigster Kongress für Lungen- und Beatmungsmedizin ist erfolgreich gestartet
Virtuelle DGHO-Frühjahrstagungsreihe am 22.03. / 29.03. / 26.04.2023: Herausforderungen in…
Pneumologie-Kongress vom 29. März bis 1. April im Congress Center…
Die Hot Topics der Hirnforschung auf dem DGKN-Kongress für Klinische…
Deutscher Schmerz- und Palliativtag 2023 startet am 14.3.
DOC-CHECK LOGIN
Neue Ära bei ALK-positivem NSCLC:
First-Line-Therapie mit Alecensa überzeugt
Grenzach-Wyhlen (15. März 2018) – „Mit der First-Line-Zulassung von Alecensa® ▼ (Alectinib) können Patienten mit ALK-positivem Lungenkarzinom nun in der ersten Behandlungslinie von der effektiven und verträglichen Therapie mit Alecensa profitieren. Dabei ist eine frühzeitige molekulare Testung die wichtigste Voraussetzung für den Therapieerfolg“, betonte Dr. Claas Wesseler, Hamburg, beim diesjährigen DGP-Kongress in Dresden. Im Rahmen eines Roche-Symposiums ging er auf die Daten der zulassungsrelevanten ALEX-Studie ein und zeigte auf, welche neuen Perspektiven sich daraus für Patienten mit fortgeschrittenem, ALK-positivem nicht-kleinzelligem Bronchialkarzinom (NSCLC) ergeben. Die Ergebnisse der Head-to-Head-Studie (Alecensa vs. Crizotinib) belegen, dass Alecensa signifikant überlegen wirksam ist: Unabhängig von ZNS-Metastasen wurde unter Alecensa das progressionsfreie Überleben (PFS) mehr als verdoppelt.1 Zudem schützt Alecensa überlegen vor der Entstehung neuer Hirnmetastasen. Darüber hinaus wurde eine deutlich bessere Wirksamkeit bei bestehenden ZNS-Metastasen beobachtet.2 Dabei war Alecensa – trotz längerer Therapiedauer – verträglicher als Crizotinib.1,2
„Die First-Line-Zulassung von Alecensa ist ein großer Fortschritt für die Therapie von Patienten mit ALKpositivem Lungenkarzinom“, so Wesseler. Damit sei – im Vergleich zu Crizotinib – eine effektivere und verträglichere Therapie von Anfang an möglich. Neben der sehr guten systemischen Wirksamkeit ist der hohe protektive Effekt auf das ZNS ein entscheidendes Kriterium für den Einsatz von Alecensa. Denn bei Patienten ohne Hirnmetastasen zu Behandlungsbeginn entwickelten sich unter einer Alecensa-Therapie deutlich seltener Metastasen im ZNS. „Für Patienten bedeutet das deutlich weniger Einschränkungen in ihrer Lebensqualität und auch für die Angehörigen führt dies zu weniger Belastungen”, erklärte Wesseler.
Diese Vorteile einer Alecensa-Therapie sind so entscheidend, dass Alecensa in der amerikanischen NCCNLeitlinie bereits als First-Line-Standard genannt wird.3 Eine zeitnahe Ergänzung in weiteren Leitlinien, wie die des ESMO, der DGHO und die S3-Leitlinie, wird erwartet: „In den Fachkreisen ist Alecensa durch den Einsatz in der zweiten Therapielinie bereits voll etabliert. Auch wenn die Leitlinienempfehlungen noch nicht veröffentlicht sind, wird Alecensa schon jetzt als neuer Standard in der First-Line-Therapie eingesetzt.“
Voraussetzung für den Einsatz des ALK-Inhibitors ist eine positive Testung auf die Treibermutation, die bereits von verschiedenen Leitlinien befürwortet wird. So spricht sich die S2-Leitlinie dafür aus, alle Patienten mit Nicht-Plattenepithelkarzinom unabhängig vom Alter und Raucherstatus und Patienten mit Plattenepithelkarzinom, die wenig oder nie geraucht haben, auf eine ALK-Mutation zu testen.4 Auch die ESMOLeitlinie 2016 empfiehlt die ALK-Testung bei allen NSCLC-Patienten mit Nicht-Plattenepithelkarzinom.5
Effektiv und protektiv
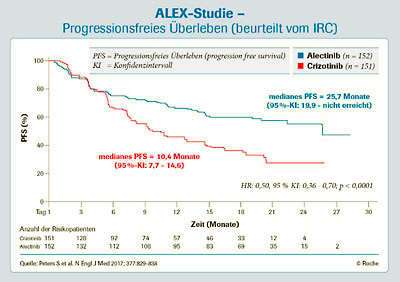
Die Ergebnisse der ALEX-Studie zeigen, dass Patienten mit Alecensa über zwei Jahre (25,7 Monate nach IRC-Bewertung) und damit mehr als doppelt so lang wie mit Crizotinib (10,4 Monate) progressionsfrei waren (s. Abb. 1). Das durch die Prüfärzte bewertete mediane PFS wurde unter Alecensa noch nicht erreicht (95 %-KI: 17,7 Monate – n. e.), während es in der Crizotinib-Gruppe bei 11,1 Monaten (95 %-KI: 9,1 – 13,1 Monate) lag.1 Ein signifikanter PFS-Vorteil konnte auch bei den nach ZNS-stratifizierten Subgruppen gezeigt werden, unabhängig der ZNS-Metastasierung zu Studienbeginn.2
Im ZNS reduzierte Alecensa in der Studie das Risiko, dass Hirnmetastasen entstehen oder dass bestehende progredient werden, signifikant um 84 % (HR: 0,16, 95 %-KI: 0,10 – 0,28; p < 0,0001).1 „Insbesondere Patienten ohne ZNS-Metastasen profitieren von dem hohen protektiven Effekt von Alecensa“, betonte Wesseler mit Blick auf die kumulative 12-Monats-Inzidenz für eine Progression im ZNS. Diese betrug bei Patienten ohne ZNS-Metastasen nur 4,6 %, während sie in der Crizotinib-Gruppe bei 31,5 % lag.2 Zudem können mit Alecensa bereits bestehende ZNS-Metastasen sehr gut therapiert werden. Bei Patienten mit messbaren zerebralen Metastasen war die ZNS-Ansprechrate unter Alecensa deutlich höher (81 % vs. 50 % unter Crizotinib).1
Von diesen Patienten hatten 38 % eine Komplettremission (vs. 5 % unter Crizotinib).1
In der ALEX-Studie wurden keine neuen Sicherheitsaspekte beobachtet und das bisherige Sicherheits- und Verträglichkeitsprofil von Alecensa bestätigt.1,2,6 Dabei war die Therapie mit Alecensa verträglicher als mit Crizotinib.1,2
![Abb. 1: Signifikante Verlängerung des progressionsfreien Überlebens unter Alecensa [mod. nach 1]](https://www.krankenpflege-journal.com/wp-kpj/wp-content/uploads/2018/03/Abb.1_Text1.jpg)
Abb. 1: Signifikante Verlängerung des progressionsfreien Überlebens unter Alecensa [mod. nach 1]
Literaturverweise
- Peters S et al. N Engl J Med 2017; 377: 829-838
- Gadgeel S et al. 1298O_PR, ESMO 2017, 8.-12.9.2017, Madrid (Spanien)
- NCCN Guidelines. Non-small cell lung cancer; Version 7, 2017
- S2-Leitlinie „Lungenkarzinom, nichtkleinzellig (NSCLC)“; Stand: 11/16
- Novello S et al. Ann Oncol 2016; 27(suppl_5): v1-v27
- Fachinformation Alecensa®, Stand: Dezember 2017
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Bitte melden Sie Nebenwirkungen an die Roche Pharma AG (grenzach.drug_safety@roche.com oder Fax oder an das Bundesinstitut für Arzneimittel und Medizinprodukte (www.bfarm.de oder Fax: +49 (0)228 / 207-5207).
Eindeutige Kennzeichnung von biologischen Arzneimitteln in der medizinischen Kommunikation
Für die Patientensicherheit ist es wichtig, biologische Arzneimittel durch ihren Handelsnamen klar zu kennzeichnen. Nur so kann gewährleistet werden, dass mögliche Nebenwirkungen eindeutig einem bestimmten Produkt zugeordnet und zurückverfolgt werden können.
Analog europäischer behördlicher Vorgaben für die Dokumentation des Handelsnamens in der Patientenakte nennt Roche in Publikationen, Texten und Presseinformationen deshalb neben dem internationalen Freinamen auch den Handelsnamen.
Roche weltweit
Roche ist ein globales Unternehmen mit Vorreiterrolle in der Erforschung und Entwicklung von Medikamenten und Diagnostika und ist darauf fokussiert, Menschen durch wissenschaftlichen Fortschritt ein besseres, längeres Leben zu ermöglichen. Dank der Kombination von Pharma und Diagnostika unter einem Dach ist Roche führend in der personalisierten Medizin – einer Strategie mit dem Ziel, jedem Patienten die bestmögliche Behandlung zukommen zu lassen.
Roche ist das größte Biotech-Unternehmen weltweit mit differenzierten Medikamenten für die Onkologie, Immunologie, Infektionskrankheiten, Augenheilkunde und Erkrankungen des Zentralnervensystems. Roche ist auch der bedeutendste Anbieter von In-vitro-Diagnostika und gewebebasierten Krebstests und ein Pionier im Diabetesmanagement.
Seit der Gründung im Jahr 1896 erforscht Roche bessere Wege, um Krankheiten zu verhindern, zu erkennen und zu behandeln und leistet einen nachhaltigen Beitrag zur gesellschaftlichen Entwicklung. Zum Ziel des Unternehmens gehört es durch Kooperationen mit allen relevanten Partnern den Zugang von Patienten zu medizinischen Innovationen zu verbessern. Auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation stehen heute 30 von Roche entwickelte Medikamente, darunter lebensrettende Antibiotika, Malariamittel und Krebsmedikamente. Ausgezeichnet wurde Roche zudem bereits das neunte Jahr in Folge als das nachhaltigste Unternehmen innerhalb der Pharma-, Biotechnologie- und Life-Sciences- Branche im Dow Jones Sustainability Index.
Die Roche-Gruppe mit Hauptsitz in Basel, Schweiz ist in über 100 Ländern tätig und beschäftigte 2017 weltweit rund 94.000 Mitarbeiterinnen und Mitarbeiter. Im Jahr 2017 investierte Roche CHF 10,4 Milliarden in Forschung und Entwicklung und erzielte einen Umsatz von CHF 53,3 Milliarden. Genentech in den USA gehört vollständig zur Roche-Gruppe. Roche ist Mehrheitsaktionär von Chugai Pharmaceutical, Japan.
- Weitere Informationen finden Sie unter www.roche.com
Alle erwähnten Markennamen sind gesetzlich geschützt.
Roche in Deutschland
Roche beschäftigt in Deutschland rund 16.100 Mitarbeiterinnen und Mitarbeiter in den Bereichen Pharma und Diagnostik. Das Unternehmen ist an den drei Standorten in Grenzach-Wyhlen (Roche Pharma AG), Mannheim (Roche Diagnostics GmbH, Roche Diagnostics Deutschland GmbH, Roche Diabetes Care GmbH sowie Roche Diabetes Care Deutschland GmbH) und Penzberg (Biotechnologie-Kompetenzzentrum, Roche Diagnostics GmbH) vertreten. Die Schwerpunkte erstrecken sich über die gesamte Wertschöpfungskette der beiden Geschäftsbereiche Pharma und Diagnostics: von Forschung und Entwicklung über Produktion, Logistik bis hin zu Marketing und Vertrieb, wobei jeder Standort neben dem Deutschland-Geschäft auch globale Aufgaben wahrnimmt. Roche bekennt sich klar zu den deutschen Standorten und hat in den letzten fünf Jahren in diese rund 2,5 Milliarden Euro investiert.
- Weitere Informationen zu Roche in Deutschland finden Sie unter www.roche.de
Roche Pharma AG
Die Roche Pharma AG im südbadischen Grenzach-Wyhlen verantwortet mit rund 1.400 hochqualifizierten Mitarbeiterinnen und Mitarbeitern das deutsche Pharmageschäft. Dazu gehören Marketing und Vertrieb von Roche Medikamenten in Deutschland sowie der Austausch mit Wissenschaftlern, Forschern und Ärzten in Praxen und Krankenhäusern. Im Bereich der klinischen Forschung koordiniert der Standort alle zulassungsrelevanten Studien für Deutschland sowie Studien für bereits auf dem Markt befindliche Produkte.
Für den europäischen Raum erfolgen in Grenzach-Wyhlen zudem zentrale Elemente der technischen Qualitätssicherung.
Quelle: Roche Pharma, 15.03.2018 (tB).